
| 操作方法 | 实验现象 |
| 将打磨过的铝放入硫酸亚铁溶液中,观察现象 或打磨过的铁钉放入硫酸铝溶液中,观察现象 | 铝表面出现固体,溶液由浅绿色慢慢变成无色 或无明显变化 |
分析 (1)根据铝易被氧气氧化、化学方程式的书写以及控制变量法来分析;
(2)根据金属的活动性以及化学方程式的书写方法来分析;
结合金属活动性顺序以及金属与盐溶液的反应来分析.
解答 解:(1)铝的化学性质比较活泼,在空气中易与氧气反应生成氧化铝,氧化铝与盐酸反应生成氯化铝和水,所以开始没有气泡产生,为了达到实验目的,除了以上条件相同外,还要控制2中金属的表面积或颗粒大小相同;故填:铝表面有一层致密的氧化铝(或未打磨金属);Al2O3+6HCl=2AlCl3+3H2O;表面积或颗粒大小;
(2)观察到铝表面产生气泡的速率比铁表面产生气泡的速率快,说明铝的活动性比铁强;铁与盐酸反应生成氯化亚铁和氢气;故填:铝的活动性比铁强;Fe+2HCl=FeCl2+H2↑;
【应用拓展】在金属活动性顺序中,排在前面的金属可以将排在后面的金属从其盐溶液中置换出来,故可设计将打磨过的铝放入硫酸亚铁溶液中,若铝表面出现固体,溶液由浅绿色慢慢变成无色或将打磨过的铁钉放入硫酸铝溶液中,无明显变化,均能说明铝比铁活泼.
故答案为:
| 操作方法 | 实验现象 |
| 将打磨过的铝放入硫酸亚铁溶液中,观察现象 或打磨过的铁钉放入硫酸铝溶液中,观察现象 | 铝表面出现固体,溶液由浅绿色慢慢变成无色 或无明显变化 |
点评 解答本题要掌握化学方程式的书写方法和金属活动性顺序等方面的知识,只有这样才能对相关方面的问题做出正确的判断.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:初中化学 来源: 题型:解答题
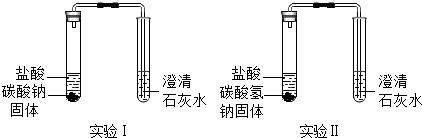
| 实验装置 | 实验现象 | 实验结论 |
| | 实验Ⅰ、Ⅱ中均观察到:白色固体逐渐减少,有气泡冒出;澄清石灰水变浑浊. | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是NaHCO3+HCl=NaCl+H2O+CO2↑. |
| t1/℃ | t2/℃ | t3/℃ | |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 甲 | 乙 | 丙 | 丁 | 图例: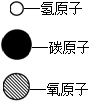 |
| 化学式 | H2O | C | ? | H2 | |
| 微观示意图 |  |  |  | ? |
 ;
;查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
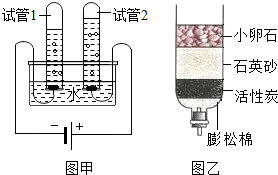
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| a.取少量样品于试管中,并加入过量的稀硝酸. | 有气泡生成. | 样品中有纯碱. |
| b.再向步骤Ⅰ中所得的溶液加入硝酸银溶液. | 有白色沉淀生成. | 样品中有氯化钠. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com