
【题目】有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag 等金属中的一种或几种组成。取该样品4.8g,加入100g 稀硫酸恰好完全反应,只得到0.4gH2和无色溶液,下列说法正确的是( )
A. 样品中一定只含有Mg
B. 样品中一定不含有Ag,可能含有Fe
C. 稀硫酸的溶质质量分数为9.8%
D. 无色溶液中溶质总质量为24g
【答案】D
【解析】
金属粉末与稀硫酸反应后恰好完全反应, 说明粉末中没有 Ag(否则固体有剩余);最终得到无色溶液,说明粉末中没有 Fe(否则溶液显浅绿色)。假设 4.8g 固体全是 Mg,与硫酸恰好反应生成 0.4g 氢气,同理计算 4.8gAl 恰好反应产生的氢气>0.4g,4.8gZn 恰好反应产生的氢气<0.4g。
根据以上分析可知:
A、样品中不一定只含有 Mg,当金属粉末为Mg、Zn、Al或Zn、Al都可能产生0.4g的氢气,故A错误;
B、样品一定没有 Ag 和 Fe,故B错误;
C、根据元素守恒,金属与酸反应生成的氢气中氢元素全部来自 H2SO4,所以H2SO4 质量= ![]() ;稀硫酸质量分数=
;稀硫酸质量分数=![]() ,故C错误;
,故C错误;
D、100g 稀硫酸中溶剂质量=100g-19.6g=80.4g,反应后溶液质量=(100g+4.8g-0.4g)=104.4g, 溶液中溶质总质量=溶液的质量-溶剂质量= 104.4g -80.4g=24g,故D 正确。故选D。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
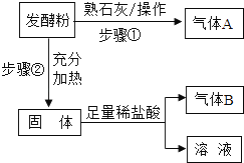
【题目】发酵粉是一种制作风味糕点的常见蓬松剂.某兴趣小组拟对其化学成分进行如下探究.
(查阅资料)①发酵粉一般含有NH4HCO3、NaHCO3、明矾[KAl(SO4)212H2O]中的2种.②已知反应:2NaHCO3
![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(1)(提出假设)假设1:有NH4HCO3和NaHCO3;
假设2:有NaHCO3和明矾;
假设3:有_____和明矾.
(2)(方案与流程)
(问题与讨论)
①步骤①的操作是在研钵中把发酵粉和熟石灰混合、研磨.
②气体A为_____.若生成A,证明假设_____或假设_____可能成立;若不生成A,证明假设_____成立.
③如果生成A,经过步骤②和步骤③后,生成气体B,则B是(填化学式)_____,证明假设_____成立,写出步骤②的化学方程式_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用右图装置探究氧气的质量分数对燃烧的影响。点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,铝盒中的白磷立即燃烧。左图是版中①二氧化碳和②氧气的含量随时间变化的图象。下列有关说法错误的是:
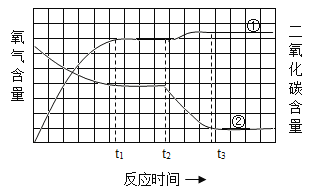
A. 在t1至t2时间段内蜡烛已熄灭而白磷还没有开始燃烧
B. 在t1至t3时间段气体含量的变化是因为磷燃烧消耗氧气生成固体
C. 该实验证明了不同物质的燃烧对氧气的质量分数需求不同
D. 该实验证明了蜡烛燃烧生成的二氧化碳气体仍能支持白磷的燃烧
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下列科普短文.
南海——我们的“聚宝盆”
南海是中国四大海域中最大、最深、自然资源最为丰富的海区。近30年来,菲律宾、越南等五国已经与西方200多家石油公司合作,在南海海域合作钻探了约1380口钻井,年石油产量达5000万吨。相当于大庆油田最辉煌时的年开采量。
材料1油气资源:南海中南部油气地质资源量占53%,可采资源量占66%,若被他国掠夺,中国海域将失去约2/3的可采油气资源。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。
材料2矿产资源:南海蕴藏5万亿吨以上的锰、约3100亿吨镁、170亿吨锡和铜、29亿吨镍及锰、8亿吨钴、5亿吨银、800万吨金、60亿吨铀等,比陆地矿产资源丰富得多。
材料3水产资源:南海海洋鱼类有1500多种,大多数种类在西、南、中沙群岛海域,很多具有极高的经济价值。海龟、海参、龙虾、螺、贝、海带等很丰富。
综合分析上述材料,回答下列问题:
(1)目前人们使用较多的化石燃料,除了南海资源中的油气外,还包括_____。
(2)对石油加热炼制时,根据各成分的沸点不同分离可得到不同的产品,该变化属于_____(填“物理变化”或“化学变化”)。
(3)天然气的主要成分是甲烷,写出其充分燃烧的化学方程式_____。
(4)材料2指出南海蕴藏着丰富的化学资源。综合利用海水制备金属镁的流程如下图所示:
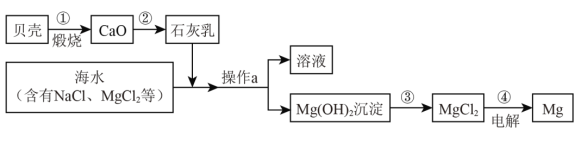
I.操作a的名称是_____,在实验室中进行此项操作,需要的玻璃仪器有烧杯、玻璃棒、_____。玻璃棒在该操作中的作用是_____。
II.写出第①、③两步反应的化学方程式:①_____,③_____。
(5)海洋鱼类、海参、龙虾富含的营养素是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量的H2SO4和CuSO4的混合溶液中,不断加入NaOH溶液,下列图像横坐标表示加入NaOH溶液的质量,纵坐标表示反应的有关量的变化情况,其中正确的是( )
A. 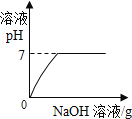 B.
B. 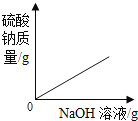
C. 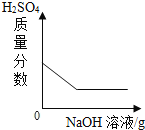 D.
D. 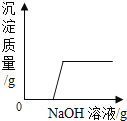
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】许多化学反应都伴随着明显的现象。但也有一些观察不到明显现象。请回答下列问题:
(1)向FeCl3溶液中滴加NaOH溶液,出现的明显现象是 。
(2)CO2与NaOH溶液的反应无明显现象。为证明二者发生了反应,小红同学设计了如图所示的实验。向一盛满CO2气体的锥形瓶中注入一定量的NaOH溶液,迅速塞紧橡皮塞(胶塞中插有一下端系小气球的玻璃管)。然后振荡锥形瓶,会观察到小气球逐渐胀大,其主要原因是 。
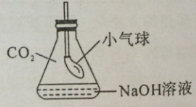
(3)盐酸与NaOH溶液的中和反应也无明显现象,为证明二者确实发生了化学反应,在向NaOH溶液中滴加盐酸前,应先向NaOH溶液中滴入少许 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
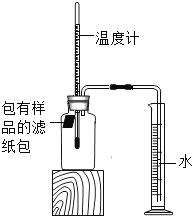
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com