
同学们在学习了酸碱盐的性质后,萌生了用身边的物质来制取新物质并研究物质性质的想法。请你参与其中,体验实验探究的快乐吧。
【粗产品制备】
课外化学兴趣小组的同学利用家里的纯碱溶液和贝壳为原料制备烧碱,按图所示流程进行实验,请你参与讨论并回答相关问题。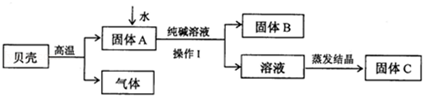
(1)贝壳高温煅烧时,发生反应的化学方程式是 ;
(2)操作Ⅰ是____________,该过程中用到的玻璃仪器有烧杯、 、玻璃棒;
(3)得到烧碱时发生反应的化学方程式为 ;
(4)得到的溶液存放在如图所示的 的瓶中(填A 或B)。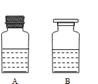
【粗产品成分分析】
将溶液蒸发结晶得到固体C,固体C中的成分有哪些呢?
甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH) 2 Na2CO3; 丁认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 ;
(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论 (填“正确”、“错误”或“无法确定”),理由是 ;
(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ;结论:由上述实验,你认为__________同学的实验结论是正确。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要虑 。
【定量分析】
(7)另称取10g上述样品C,放入盛有100g7.3%的稀盐酸的烧杯中,恰好完全反应,反应后将所得溶液蒸发,求得到的氯化钠固体质量(写出过程2分)。
【粗产品制备】
(1)CaCO3 CaO + CO2↑;(2)过滤;漏斗(3)Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH (4)A
CaO + CO2↑;(2)过滤;漏斗(3)Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH (4)A
【粗产品成分分析】
NaOH Na2CO3;丙 ; Ca(OH)2与Na2CO3不共存;(5)错误 碳酸钠、氢氧化钙也显碱性(其他合理答案亦可);(6)Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;丁
【反思拓展】: 反应物的过量
【定量分析】(7)11.7g
解析试题分析:(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3 CaO + CO2↑;(2)操作Ⅰ是固液分离的过滤操作,该过程中用到的玻璃仪器有烧杯、漏斗、玻璃棒;(3)得到烧碱时发生反应的化学方程式为Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH;(4)得到的是氢氧化钠溶液故应存放在胶塞的试剂瓶中,故选择A的瓶中;【粗产品成分分析】根据物质的反应程度,讨论剩余情况,故丁认为可能含有NaOH Na2CO3;【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是Ca(OH)2与Na2CO3不共存;(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论错误,理由是碳酸钠、氢氧化钙的溶液也显碱性;(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;结论:由上述实验,你认为丁同学的实验结论是正确。【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否过量【定量分析】
CaO + CO2↑;(2)操作Ⅰ是固液分离的过滤操作,该过程中用到的玻璃仪器有烧杯、漏斗、玻璃棒;(3)得到烧碱时发生反应的化学方程式为Ca(OH)2 + Na2CO3=CaCO3↓+ 2NaOH;(4)得到的是氢氧化钠溶液故应存放在胶塞的试剂瓶中,故选择A的瓶中;【粗产品成分分析】根据物质的反应程度,讨论剩余情况,故丁认为可能含有NaOH Na2CO3;【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是Ca(OH)2与Na2CO3不共存;(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论错误,理由是碳酸钠、氢氧化钙的溶液也显碱性;(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为Na2CO3 + Ba(NO3)2 =BaCO3 ↓+2NaNO3 ;结论:由上述实验,你认为丁同学的实验结论是正确。【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否过量【定量分析】
(7)解:设生成氯化钠的质量为X
HCl ~ NaCl
36.5 58.5
100×7.3% X 1分
36.5 :100×7.3% = 58.5: X
X =11.7g 1分
考点:酸碱盐的性质、有关化学方程式的计算


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:初中化学 来源: 题型:探究题
(7分)二氧化硫与二氧化碳具有某些相似的化学性质。为研究二氧化硫的性质,化学小组同学用如图所示装置进行实验。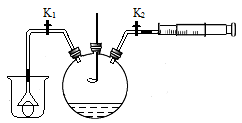
关闭K1、K2,将燃烧匙中硫粉在空气中点燃,迅速伸入如图所示瓶中,可以观察到火焰呈蓝紫色,则瓶内的气体是 ,硫燃烧反应的化学方程式是 。瓶内的石蕊溶液由紫色变为红色,原因是 。
(1)若只打开K1,烧杯内的兵乓球被吸在漏斗口,原因是 。
(2)若注射器中盛有溶液A,只打开K2,可观察到的现象是 ,瓶内溶液变为蓝色,溶液A一定具有的性质是 。
(3)若注射器中盛有澄清石灰水,打开K1、K2,向外拉注射器,可观察到澄清石灰水变浑浊,反应的化学方程式是 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小明对家里月饼包装中袋装防腐剂,品名为“504双吸剂”,其标签如图所示,对固体的成分产生了兴趣。
于是和同学一起,设计实验进行探究:
[提出问题]久置固体的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
[实验探究1]甲同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有 和氢氧化钙.此过程的化学方程式 。 |
| (2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有 ,一定不含 。 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | | 固体中一定含有CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
同学们运用对比的学习方法探究碱的性质。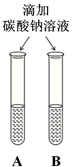
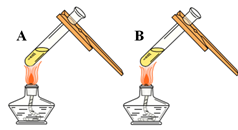
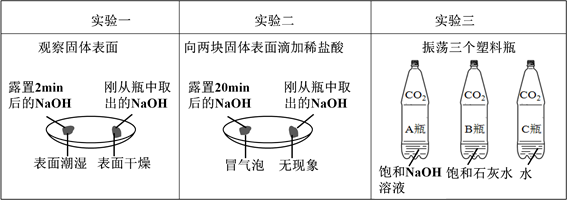
(1)由上图实验一、二可知,氢氧化钠会吸收空气的 ,因此要密封保存。
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为 ,对比A瓶与 (选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应。
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙溶液(分别编号为A、B)。
| 方案一 | 方案二 | 分析 |
| 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为 ; 方案二的设计原理是利用了 。 |
 2NaOH + H2↑ + Cl2↑,
2NaOH + H2↑ + Cl2↑,查看答案和解析>>
科目:初中化学 来源: 题型:探究题
水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。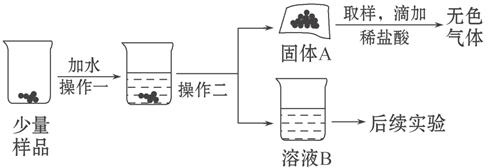
请你参与探究过程:
(1)为了使样品充分溶解,操作一还要用到的玻璃仪器是 ;操作二的名称是 。
(2)固体A中一定含有 。
(3)溶液B成分的探究:
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性。
【猜想】溶液B中的溶质可能为:①NaOH ②Na2CO3
③NaOH和Na2CO3④Ca(OH)2和 (填化学式)。
【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3。
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH。
【反思与评价】丙同学认真分析上述两位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为溶液B中的溶质一定含有Na2CO3,可能含有NaOH。为进一步确认溶液B中是否含NaOH,他做了如下实验。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液 ②过滤,在滤液中滴加酚酞试液 | ①有白色沉淀生成 ②溶液由无色变为红色 | 猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如下,据图回答: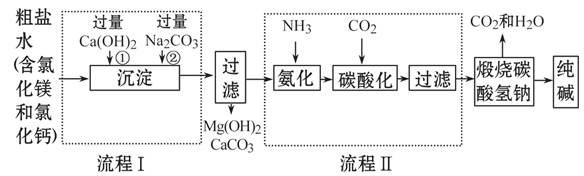
(1)流程Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?为什么? 。
(2)用一个化学反应方程式表示出流程Ⅱ中发生的总反应 。
(3)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用是 。
(4)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
珍珠粉以其良好的养颜等功效,获得消费者喜爱。资料显示:珍珠中含碳酸钙80﹣93%、蛋白质4﹣14%、水份2﹣4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案。
【探究一】辨别市售珍珠真与假。
将其分别溶于水,充分搅拌、静置,测定上层清液的pH;若pH 7(填“>”或“<”或“=”)为假珍珠,理由是 。
【探究二】测定珍珠中碳酸钙含量。
小王用如图所示装置测定该珍珠粉中碳酸钙的含量,实验方案如下: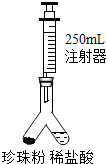
(1)检查装置气密性:按图1连接装好置后,将注射器活塞(规格为250mL,不考虑活塞的摩擦和自重,下同)从刻度10mL处向上拉至刻度20mL处, (填操作和现象),则气密性良好;(2)在图1异型装置左管内装入1.1g 上述珍珠粉样品,右管内倒入一定量的稀盐酸,注射器活塞推到底部,再次连接装置;
(3)设法使左右两管内的药品混合,反应结束后读取注射器读数为220mL;
(4)数据处理:计算得该珍珠粉中碳酸钙的质量分数为 。[ρ〔CO2〕=2g/L,结果保留小数点后1位]
【实验思考】((1)此实验中的反应原理是 (用化学方程式表示);
(2)考虑注射器因素,该实验方案对珍珠粉的用量多少是否必须作要求? ;
(3)【探究二】中的第(3)步,混合两种药品的方法是 ;
(4)该实验装置设计上的优点在于 (写出1点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品,反应的化学方程式为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑。某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑。某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究。
[提出问题]:烧碱样品中含有哪些杂质?
[猜想]:
(1)可能含有NaCl,作出此猜想的依据是电解的过程中氯化钠没有完全反应。
(2)可能含有碳酸钠,做出此猜想的理由是 (用化学方程式表示)。
[实验设计]
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量的烧碱样品置于试管中加水溶解,用手触摸试管外壁。 | 试管外壁发热。 | 原因是 |
| ②向①所得的溶液中加入盐酸至过量。 | 开始时无明显现象,过一段时间后有气泡产生。 | 说明样品中含有杂质 |
| ③向②所得的溶液中加入硝酸银溶液。 | 有白色沉淀产生。 | AgNO3+NaCl=AgCl↓+NaNO3 说明样品中含有杂质氯化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
(5分)A、B、C、D、E、F、G、H之间的相互转化关系如图,它们均是初中化学中常
见的物质,其中A 常用作酒精灯的燃料;B、C是气体,且B是单质;E是含钠元素的
化合物,H的固体曝露在空气中容易潮解。
(1)A的化学式是 ,反应①属于 反应;
(2)写出反应②的化学方程式 ;
(3)A~H中能使酚酞试液变红的有 种;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com