
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
分析 本题通过实验探究了能使带火星的木条复燃的氧气含量的最低值问题,针对此问题,设计了几组氧气含量不同的对照实验.
(1)通过实验可以看出,不是纯净的氧气,带火星的木条也可以复燃;
(2)分析表格可发现收集的氧气占容积的体积分数最低为35%时木条就可复燃,根据空气中原有的氧气和收集到的氧气,就可算出氧气的分数;
(3)根据上题数据,结合坐标图,就可以查知温度的大约值;
解答 解:(1)通过实验可以看出,氧气含量达到35%带火星的木条就可以复燃,所以用带火星的木条验满氧气的方法不可靠,所以本题答案为:否,
(2)观察实验记录,收集的氧气占容积的体积分数最低为35%,带火星的木条复燃,此时空气还占65%,所以空气中有氧气的量为:65%×21%≈14%,所以此时瓶内共有氧气的分数为:14%+35%=49%,若用氧气占空气体积的五分之一计算,则结果为48%,所以本题答案为:35,48或49;
(3)只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,则氧气的含量需要在48%~49%,分析坐标,可知道温度大约在87°左右;所以本题答案为:等于.
点评 设计实验时,要明确实验的目的,要注意控制一些变量,本题还采用了“半值法”,从而可减少实验的次数,减少实验的过程.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 11.2g | B. | 22.4g | C. | 44.8g | D. | 89.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| $\stackrel{-1}{Cl}$ | $\stackrel{-2}{O}$ | $S\stackrel{-2}{{O}_{4}}$ | |
| $\stackrel{+1}{Na}$ | |||
| $\stackrel{+2}{Ca}$ | |||
| $\stackrel{+3}{Fe}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
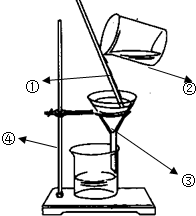 (1)指出图中所标的仪器的名称
(1)指出图中所标的仪器的名称查看答案和解析>>
科目:初中化学 来源: 题型:解答题
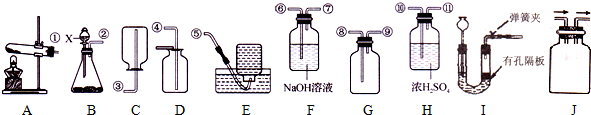
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
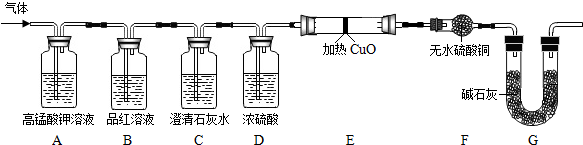
| 实验过程 | 实验现象 | 实验结论 |
| 1°气体通过高锰酸钾溶液. | 高锰酸钾溶液褪色. | 猜想4成立 |
| 2°气体通过澄清石灰水. | 澄清石灰水变浑浊. | |
| 3°气体通过氧化铜和无水硫酸铜. | 黑色氧化铜变红色,无水硫酸铜变蓝色(合理即可). |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
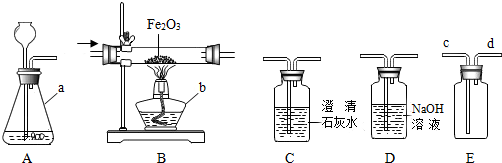
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com