
【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究,请你参与。
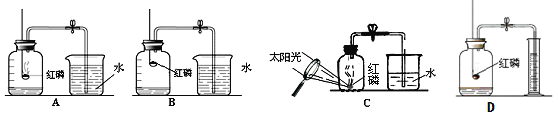
【设计实验】第一小组同学共同设计了如上图的A、B两套装置。 你认为合理的是(填编号)________ 。
【进行实验】
【数据分析】 实验结束后,整理数据如下:(注:集气瓶容积为100ml)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入瓶中水的体积(ml) | 20 | 18 | 19 | 17 | 21 | 19 |
通过对实验数据分析,实验得出氧气约占空气体积的___________。
【实验分析】(1)红磷要足量的原因是___________________________;
(2)发生反应的化学方程式是____________________________;
(3)实验结束,发现测定出的空气中氧气的体积分数低于l/5,可能的原因是______
①可能使用红磷的量不足,瓶内氧气没有消耗完
②可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
③可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
④可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
【改进实验】
(1)第二小组同学设计了C实验装置,优点是:________________________________。
(2)第三小组同学设计了D实验装置,优点是:_______________________________。
【答案】 A 五分之一 略 略 ①③ 略 略
【解析】【试题分析】本题考查测定氧气在空气中的体积分数,实验中要注意装置的严密性、所用药品的量、生成物的状态、氧气不足1/5的误差分析、对实验现象的分析等。
【设计实验】:实验A和B的区别在于红磷的位置,而这一点与氧气的密度有关,由于氧气的密度大于空气,所以红磷在稍微低的位置更利于反应的进行,也更利于氧气的消耗,所以实验设计A更合理;
【数据分析】根据集气瓶的容积是100ml,进入水的量的几次不同结果求其平均值可得:进入水量的平均值是19ml,所以进入水量占总容积的19%,即氧气量约占空气体积的五分之一;
【实验分析】:(1)红磷足量可充分消耗的氧气,使测量的结果更准确;
(2)红磷燃烧的化学方程式为:4P+5O2点燃2P2O5
(3)①实验中所取红磷的量不足时,会导致装置内氧气不能全部消耗,因此使测得氧气的体积分数会小于的![]() ;
;
②实验前若没有将弹簧夹夹紧,会导致实验中装置内的气体受热膨胀而逸出,因此测得氧气的体积分数会大于![]() 的;
的;
③未塞紧瓶塞,冷却时会使空气进入集气瓶内,因此测得氧气的体积分数小于的![]() ;
;
④插入燃烧匙太慢,塞紧瓶塞之前,瓶内的部分空气受热逸出,因此测定氧气体积分数大于的![]() ;综上所述就选①③
;综上所述就选①③
【改进实验】:(1)实验C是在装置内点燃,生成的五氧化二磷不会跑到空气中,也就是红磷燃烧的产物有毒的五氧化二磷不会散失到空气造成环境污染,节约了红磷,故C装置的优点是:环保.同时也利于实验的结果的准确.
(2)采用量筒进行实验的优点是方便、准确计算进入集气瓶中水的体积。


科目:初中化学 来源: 题型:
【题目】用“![]() ”和“
”和“![]() ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如下图所示,下列说法正确的是
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如下图所示,下列说法正确的是
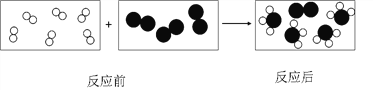
A. 该反应是分解反应
B. 该反应有2种生成物
C. 每个生成物分子由3个原子构成
D. 参加反应的“![]() ”和“
”和“![]() ” 分子的个数比是 3︰1
” 分子的个数比是 3︰1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知X、Y、Z三种金属能发生下列反应:X+H2SO4═XSO4+H2↑,
Y+Z(NO3)2═Y(NO3)2+Z,
Z+X(NO3)2═Z(NO3)2+X,则X、Y、Z三种金属与氢的活动性由强到弱的顺序为( )
A.X>H>Y>Z B.Y>Z>X>H C.Z>Y>X>H D.X>H>Z>Y
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和空气是人类赖以生存的自然资源, “节约水资源,防止空气污染,人人有责”。
(1)下列有关水和空气的叙述中正确的是____。
A、淡水资源并不充裕,将工业冷却水循环利用 、生活中一水多用等值得提倡
B、充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生
C、东台梁垛磊达水泥厂进行了废气除尘后再排放有利于防止空气污染
D、空气是重要的自然资源,其成分在生活、工农业生产等活动中有许多应用
(2)几年前广山地区生活用水使用的深井水,可以用___________检验是否为硬水,生活中常用_______的方法降低水的硬度;现在使用的是长江水,下图是东台自来水厂净化水的流程图,请根据流程图回答下列问题:
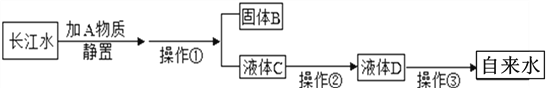
Ⅰ.操作①的名称是_____________,实验室进行该操作需要用到的玻璃仪器有漏斗、烧杯和 _________,所填仪器在实验中作用是_______________。
Ⅱ.操作③用的是漂白粉,其中有效成分的作用是Ca(ClO)2+X+H2O=CaCO3↓+2HClO, HClO具有杀菌消毒作用,X是空气中一种不可或缺的成分,植物可利用它进行光合作用,则它是__________ (填化学式)。
(3)如图是电解水的装置,根据图回答下列各问题:
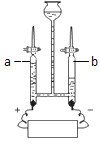
Ⅰ.指出电源的正、负极:b为________极,该电极产生了10毫升气体,则电源另一极产生气体的体积是____________,该反应的符号表达式是_______________________,实验过程中事先往水中加入少量NaOH,其目的是_______________________;
Ⅱ.由以上实验事实可得出结论,说明水是由_____________组成。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组利用以下装置探究气体的制取及性质。结合下图回答有关问题:
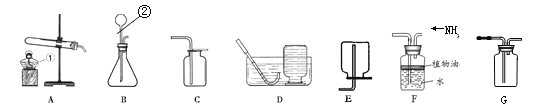
请结合图示实验装置,回答下列问题。
(1)图中标号的仪器名称①___________,②___________。
(2)若选择氯酸钾制取氧气,该反应的符号表达式为________________________,实验中收集的氧气用于完成铁燃烧的实验,则可选用的装置组合是________,实验结束后,应该先_______________,再________________; 若改用装置G收集氧气,氧气应从________端通入(选填“左”或“右”)。
(3)已知NH3极易溶于水且与能水反应,密度比空气小,实验室可用固体氢氧化钙[Ca(OH)2]和氯化铵(NH4Cl)加热来制取NH3,同时生成氯化钙(CaCl2)和水, 该反应的符号表达式为_______________________,若用F装置收集NH3,油层的作用是 ____________________。
(4)萌萌同学通过互联网得知:多种物质都能催化过氧化氢的分解。
【初次探究】实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解,如果要确定CuSO4是催化剂,还必须通过实验确定它在化学反应前后质量和________不变。
【再次探究】CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),稀硫酸中含有三种粒子(H2O、H+、SO42-)为了进一步探究CuSO4溶液中哪种粒子能起催化作用。萌萌同学作了以下分析和设计。
①萌萌同学认为最不可能的是H2O,他的理由是 ____________________ 。
②要说明另外的两种粒子是否起到催化作用,萌萌同学设计了如下实验,完成了探究活动。
实验步骤 | 实验现象 | 结论 |
取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是____ |
b. 另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴氯化铜溶液 | 溶液中有大量气泡放出 |
(5)可可同学称取一定质量的高锰酸钾固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,该同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想 I:反应生成的锰酸钾分解放出O2;
猜想Ⅱ:_____________________________ ;
猜想Ⅲ:反应生成的锰酸钾和二氧化锰都分解放出O2;
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想______错误;
第二组同学取锰酸钾在250℃条件下加热,没有用测定质量的方法得出了猜想I正确的结论。该组同学选择的实验方法是________________________。
【拓展延伸】实验发现,氯酸钾固体加热制取氧气的反应速率很慢,但如果将高锰酸钾固体与氯酸钾固体混合加热,则氯酸钾的分解速率大大加快。请说明高锰酸钾在氯酸钾的分解反应中是否作催化剂,为什么?_______________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学加热33g氯酸钾和二氧化锰混合物制氧气,至混合物质量不再减少时得到23.4g固体。求:
(1)生成氧气的质量?
(2)反应前混合物中二氧化锰的质量分数?(计算结果保留至1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中央电视台曝光部分药品胶囊重金属铬元素含量超标。如图是元素周期表中关于铬元素的信息图,你认为从图中获得的信息正确的是( )

A. 该元素的原子核内中子数为24 B. 该元素属于非金属元素
C. 该原子的相对原子质量为52.00g D. 该元素的原子核外有24个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com