
【题目】水与人类的生活和生产密切相关,请回答下列问题:
(1)电解水实验揭示了水的组成。如图1实验中得到氧气的试管是_____(填“1”或“2”)
(2)自来水厂净水过程中用到活性炭,其作用是_____。
(3)海水淡化可缓解淡水资源匮乏的问题,如图2为太阳能海水淡化装置示意图。
①水变成水蒸气的过程中,不发生变化的是_____(填字母序号)
A 分子质量 B 分子种类 C 分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会_____(填“变大”、“变小”或“不变”)
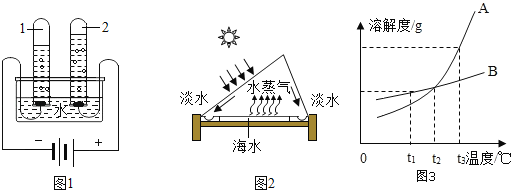
(4)如图3是A、B两种物质的溶解度曲线,根据图示回答问题:
①t1℃时,A、B两种物质的溶解度是A_____B(填“>”、“<”或“=”,下同)。
②将t3℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A_____B。
(3)t2℃时,100g水中溶解50gA刚好饱和,那么50g水中溶解_____gB也刚好达饱和,此时溶液的质量分数是_____(精确到0.1%)。
【答案】2 吸附 A、B 变大 < > 25 33.3%
【解析】
(1)电解水时,正极产生氧气,负极产生氢气,氢气是氧气体积的2倍,由电解水装置示意图可知,2试管里的气体是电源上的正极产生的气体,是氧气;
(2)自来水厂净水过程中用到活性炭,其作用是吸附作用,除掉水中的色素和异味;
(3)水变成水蒸气的过程中是物理变化,分子质量和分子种类不变,分子间隔改变;将一定量的海水暴晒一段时间后,溶剂减少,溶质不变,剩余海水中氯化钠的质量分数会变大;
(4)①t1℃时,A、B两种物质的溶解度是A<B;
②由图可知:将t3℃的A、B两种物质的饱和溶液各200g,降温至t1℃,A的溶解度变化幅度大于B,所以析出晶体的质量比B多;
③t2℃时AB的溶解度曲线交于一点,说明该温度下二者的溶解度相等,100g水中溶解50gA刚好饱和,即二者在该温度下的溶解度均为50g,那么50g水中溶解25gB刚好饱和;此时溶液的质量分数=![]() ×100%≈33.3%。
×100%≈33.3%。


科目:初中化学 来源: 题型:
【题目】控制变量设计对比实验是实验探究的重要方法,请参与下列探究并回答问题:
实验一:探究影响过氧化氢溶液分解速率的因素

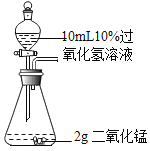
A B
同时打开A和B装置中分液漏斗的旋塞,根据锥形瓶内产生气泡的速率,得出_________会影响过氧化氢溶液的分解速率,为准确直观比较分解速率的快慢,可测定相同时间内收集到的氧气体积,或者测定_________。
实验二:探究金属与盐溶液的反应
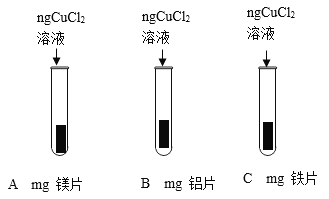
将打磨过的镁片、铝片、铁片分别与氯化铜溶液反应,观察到金属表面都有红色物质生成且镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡产生经查阅资料知氯化铜溶液呈酸性。请写出B试管内发生反应的化学方程式__________________;由此实验______________(填能或否)得出镁铝铁铜四种金属的活动性顺序。
实验三:探究二氧化碳能否与碱溶液反应
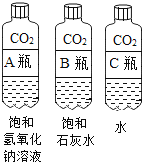
①对比 A 瓶与 B 瓶的实验现象,请说明实验室用氢氧化钠溶液吸收CO2,用石灰水检验二氧化碳的理由_________;
②A瓶与 B瓶的对比,因为 A瓶严重变瘪,说明_________消失,可证明二氧化碳与氢氧化钠溶液发生了反应,也可以通过加入下列物质中的_________证明新物质的生成,从而说明反应的发生。
A 酚酞试液 B 稀盐酸 C Ca(OH)2溶液 D CaCl2溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
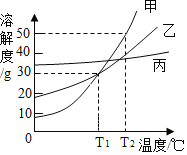
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映对应的实验操作的是
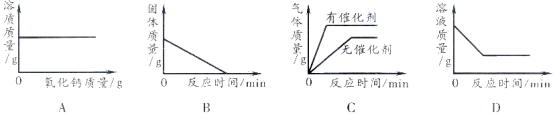
A.向一定量的饱和石灰水中加入氧化钙
B.加热一定量高锰酸钾固体产生氧气
C.用一定量的双氧水制取氧气
D.向一定量的硝酸银溶液中插入铜
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、MgO等。研究小组对其进行综合处理的流程如下:资料①:SiO2、Al2O3可溶于氢氧化钠溶液;资料②:MgCl2溶液加热容易水解产Mg(OH)2。
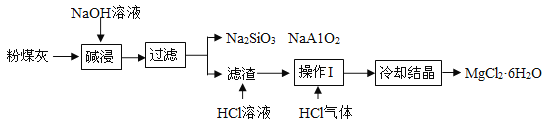
(1)火电厂发电采用的固体燃料主要是煤,化石燃料除煤外还有_____________(填一种即可)。人们开发 和应用的清洁能源有_____________(填一种)。
(2)碱浸溶解SiO2(性质与CO2相似)的反应化学方程式为_____________。
(3)粉煤灰碱浸时通常需要在较高温度下进行,原因是_____________。
(4)滤渣中加入稀盐酸发生反应的化学方程式为___________。
(5)操作I的名称是___________。
(6)加热浓缩时通入HCl气体的目的是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中化学常见物质,已知B为黑色固体,D为红色固体单质,F为红色固体,他们的转化关系如图所示。请回答下列题:
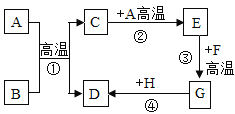
(1)物质B、E的化学式分别为、_____________。
(2)反应③的化学方程式分别为________,反应③在实际生产中的应用是________。
(3)反应①、③的基本反应类型是否相同?_____________(填“相同”或“不同”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学学习中,了解知识的发展历程,可以促进我们正确理解科学本质。
(1)火药起源于唐朝。制作烟花的火药中加入镁粉,是为了引燃后能看到______________。
(2)十八世纪,化学家发现某些金属与酸反应能生成一种气体,该气体被称为“会制造水的物质”。写出该气体燃烧制造水的化学方程式:______________。
(3)俄国化学家贝开托夫于1865年发表了金属活动性顺序。某同学将铝片放入氯化铜溶液中,发现有红色固体和无色气体生成。
①写出生成红色固体的化学方程式:_______________。
②利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示),
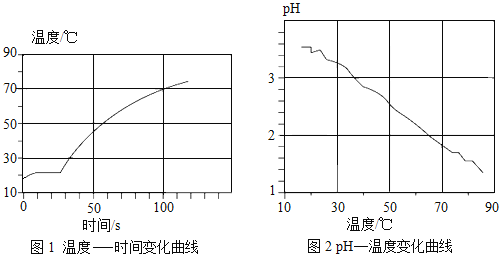
说明该过程_________(“放热”或“吸热”),溶液的酸性_______(“增强”或“减弱”);推测铝与溶液中的H+反应生成无色气体是_______________(填物质化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料广泛应用于生产生活中。
(1)常温下大多数金属是固体,但体温计中的金属是液体,该金属是________。用微粒的观点解释利用该金属应于体温的填充剂的原因:___________。
(2)贯休的《读唐史》中“洪炉烹五金,黄金终自奇”从金属的化学性质说明了金的化学性质是__________(填“活泼”或“不活泼”)。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_________(写化学式),试写出其中发生反应的化学方程式____________。
(4)用金属铁制备新型消毒、净水剂K2FeO4的流程图所示:
![]()
①步骤Ⅰ反应的发生反应的基本类型是___________。
②K2FeO4中Fe元素的化合价为_________。
③步骤Ⅱ发生得复分解反应的化学方程式为_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究元素知识是学好化学的基础,如表包含部分元素的相关信息,请完成填空。
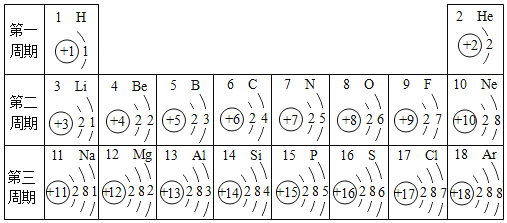
(1)1869年,俄国化学家_____发现了元素周期律并编制了元素周期表;
(2)用正确的化学用语填空:两个氢原子_____;2个氧分子_____;3个亚铁离子_____;氧化铝中铝元素显+3价_____
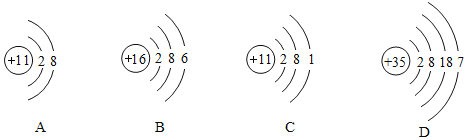
(3)下列图中微粒共表示_____种元素,其中与氯元素具有相似化学性质的是_____![]() 填序号
填序号![]() 。其中D元素位于第_____周期。
。其中D元素位于第_____周期。
(4)写出原子序数为1、6、8、11四种元素所组成化合物的化学式_____。
(5)通过分析,同一横行元素之间的排列有一定的规律,如:①从左到右,由金属元素逐渐向非金属元素过渡;②从左到右,各元素原子的电子层数相同;③_____(任写一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com