
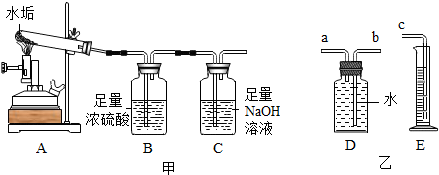
 某学习小组对硫酸进行如下研究:
某学习小组对硫酸进行如下研究:| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水 质量/g | 浓硫酸 | 1.6 | 2.2 | 5.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 稀硫酸 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
分析 (1)实验室制氢气、二氧化碳都可用固液常温型装置,根据书写方程式的原则书写化学方程式
(2)根据题意硫酸浓度越大,酸性越强,根据溶液酸性与pH的关系分析;根据能否发生化学反应以及溶液pH的变化;
(3)①根据溶质质量分数的计算公式计算体积比为1:1稀硫酸的溶质质量分数;根据量取俯视读数时实际量取的浓硫酸的量分析配置的稀硫酸的溶质质量分数的变化;
②a根据分析表中的数据,分析硫酸的吸水性;b根据浓硫酸的吸水性分析.
解答 解:(1)仪器名称为分液漏斗,锌与稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4 ═ZnSO4+H2↑
该装置是固液常温型装置,实验室还可用此装置制取二氧化碳,化学方程式为
(2)根据题中信息,相同温度下,硫酸中溶质的质量分数越大,溶液酸性越强,pH越小,故常温下10%的稀硫酸的pH<2%的硫酸;A、稀硫酸中加水溶液pH升高,但此变化是物理变化;B、加铁粉,硫酸与铁反应生成硫酸亚铁和氢气,使溶液的pH增大,正确;C、加少量氢氧化钾,硫酸与氢氧化钾反应生成硫酸钾和水,使溶液pH增大;正确;D、加少量浓硫酸,溶液pH降低,故D错误;故选BC;
(2)①要配置体积比为1:1稀硫酸,设取溶质质量分数为98%的浓硫酸的体积为v,取水的体积也为v,则体积比为1:1稀硫酸的溶质质量分数计算表达式为:$\frac{v×1.84g/c{m}^{3}×98%}{v×1.84g/c{m}^{3}+v×1g/c{m}^{3}}$×100%;在量取时浓硫酸时是俯视读数,实际量取的浓硫酸少了,所配置的稀硫酸的质量分数偏小;
②a由表中的数据可知:浓、稀硫酸都有吸水性,浓硫酸的吸水性比稀硫酸的吸水性强;
b由于浓硫酸有吸水性,所以,浓硫酸在保存时要密封保存,可用作某些气体的干燥剂.
故答案为:(1)分液漏斗;Zn+H2SO4 ═ZnSO4+H2↑;二氧化碳;CaCO3+2HCl═CaCl2+H2O+CO2↑;(2)<;BC;
(3)①$\frac{v×1.84g/c{m}^{3}×98%}{v×1.84g/c{m}^{3}+v×1g/c{m}^{3}}$×100%;偏小;②a B,b密封,浓.
点评 本题主要考查了有关硫酸的知识,要想解答好这类题目,就要理解和熟记硫酸的化学性质、用途、反应现象和化学方程式,以及与之相关的知识.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入过量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl; |
| (2)将上述反应后的混合物过滤,取滤液加入酚酞试液.. | 溶液变红色. | 证明猜想Ⅱ正确 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
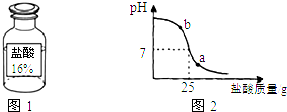
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
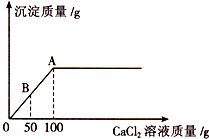 五一节后,小丽带着愉快的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.
五一节后,小丽带着愉快的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.| 阴离子 阳离子 | 0H- | N03- | C1- | C032- |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 溶 | 不溶 |
| Cu2+ | 不溶 | 溶 | 溶 | 不溶 |
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液 | 产生白色沉淀,溶液变红 | NaOH溶液部分变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com