
 五一节后,小丽带着愉快的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.
五一节后,小丽带着愉快的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.| 阴离子 阳离子 | 0H- | N03- | C1- | C032- |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 溶 | 不溶 |
| Cu2+ | 不溶 | 溶 | 溶 | 不溶 |
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液 | 产生白色沉淀,溶液变红 | NaOH溶液部分变质 |
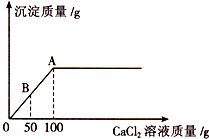
分析 氢氧化钠在空气中会与空气中的二氧化碳反应生成碳酸钠,检验氢氧化钠是否全部变质也就是看碳酸钠中还有没有剩余的氢氧化钠,主要根据检验碳酸根离子和氢氧根离子的方法来确定.检验碳酸根离子但不会除去氢氧根离子应用钙离子或钡离子,但不可混入氢氧根离子.以免对氢氧化钠的检验造成影响.当滴加氯化钙溶液到B点时,碳酸钠未反应完,还有生成的氯化钠,可能还有未变质的氢氧化钠.欲求待测溶液中碳酸钠的质量分数,必须要知道碳酸钠的质量和待测溶液的质量,待测溶液的质量已知,碳酸钠的质量可根据沉淀碳酸钙的质量求出.
解答 解:【提出猜想】NaOH溶液全部变质
【实验探究】氢氧化钠在空气中会与空气中的二氧化碳反应生成碳酸钠,检验氢氧化钠是否全部变质,也就是看碳酸钠中还有没有剩余的氢氧化钠.通过检验碳酸根离子和氢氧根离子的方法可以确定.故答案为:产生白色沉淀,溶液变红
产生白色沉淀,溶液不变红
【实验反思】(1)若用氢氧化钡或氢氧化钙的话,即使原溶液中没有氢氧化钠反应也会生成氢氧化钠.故答案为:③④
(2)氢氧化钠敞口放在空气中会变质,故应密封保存.故答案为:密封
【拓展应用】
(1)当氯化钙溶液滴加到B点时,碳酸钠没有反应完,还有生成的氯化钠,原溶液中可能还有未变质的氢氧化钠.故答案为:NaOH、NaCl、Na2CO3或NaCl、Na2CO3
(2)解:设Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
x 100g×1.11%
=1.11g
$\frac{106}{x}$=$\frac{111}{100g×1.11%}$
x=1.06g
待测溶液中碳酸钠的质量分数为$\frac{1.06g}{20g}$×100%=5.3%
答:待测溶液中碳酸钠的质量分数为5.3%
点评 检验混合溶液中有碳酸钠和氢氧化钠时,因为碳酸钠溶液显碱性,会对氢氧化钠的检验造成干扰,应先检验并除去碳酸钠,再检验氢氧化钠.还应注意在检验并除去碳酸钠时不能混入氢氧根离子.


科目:初中化学 来源: 题型:解答题
 某学习小组对硫酸进行如下研究:
某学习小组对硫酸进行如下研究:| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水 质量/g | 浓硫酸 | 1.6 | 2.2 | 5.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 稀硫酸 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
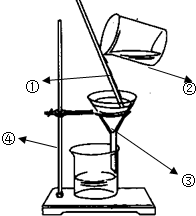 (1)指出图中所标的仪器的名称
(1)指出图中所标的仪器的名称查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
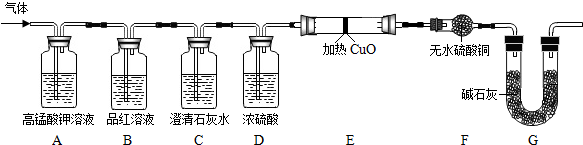
| 实验过程 | 实验现象 | 实验结论 |
| 1°气体通过高锰酸钾溶液. | 高锰酸钾溶液褪色. | 猜想4成立 |
| 2°气体通过澄清石灰水. | 澄清石灰水变浑浊. | |
| 3°气体通过氧化铜和无水硫酸铜. | 黑色氧化铜变红色,无水硫酸铜变蓝色(合理即可). |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂试剂 | |
| A | Fe粉 | Cu粉 | 稀盐酸 |
| B | CO | CO2 | 澄清石灰水 |
| C | CaCO3 | CaCl2 | 水 |
| D | O2 | 水蒸气 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com