
【题目】将22.2gCu2(OH)2CO3放在密闭容器内高温加热一段时间后,冷却,测得剩余固体的质量为15.2g。在剩余固体里加入100.0g稀硫酸恰好完全反应,过滤得红色金属。已知:Cu2O+H2SO4 =Cu+CuSO4+H2O,下列说法正确的是
A. 15.2g剩余固体是纯净物 B. 过程中生成CO2和H2O的质量和为7.0g
C. 残留红色金属质量为12.8g D. 稀硫酸的溶质质量分数为14.7%
【答案】D
【解析】分析:根据题中信息可知,碱式碳酸铜分解时,部分生成了氧化铜,部分生成氧化亚铜,设分解生成氧化铜的碱式碳酸铜的质量为m,生成氧化铜的质量为x,则
Cu2(OH)2CO3![]() CuO + H2O + CO2↑
CuO + H2O + CO2↑
222 80
m x 得① 222/m=80/x
2Cu2(OH)2CO3![]() 2 Cu2O + 2H2O + 2CO2↑+ O2↑
2 Cu2O + 2H2O + 2CO2↑+ O2↑
2×222 2×144
22.2g-m 15.2g-x 得② 2×222/ 2×144=(22.2g-m)/( 15.2g-x)
由①②计算可得m=11.1g x=8g
因此生成氧化铜、氧化亚铜的碱式碳酸铜的质量均为11.1g,生成氧化亚铜的质量为15.2g -8g=7.2g;设生成铜的质量为y,与氧化亚铜反应的硫酸的质量为n1,与氧化铜反应的硫酸的质量为n2,则:
Cu2O + H2SO4 = Cu+CuSO4+H2O
144 98 64
7.2g n1 y
![]() n1=4.9g y=3.2g
n1=4.9g y=3.2g
CuO + H2SO4 = CuSO4+H2O
80 98
8g n2
![]() n2=9.8g
n2=9.8g
所以:A. 剩余固体加硫酸后生成铜,说明15.2g剩余固体是氧化铜和氧化亚铜,是混合物,错误; B. 过程中生成CO2和H2O、氧气的质量和为7.0g,错误;C. 残留红色金属为铜,质量是3.2g,错误;D. 稀硫酸的溶质质量分数为(9.8g+4.9g)÷100g×100%=14.7%,正确。故选D。


科目:初中化学 来源: 题型:
【题目】兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了如下探究实验。请你与他们一起完成以下探究活动:
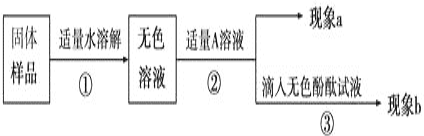
【对固体猜想】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:_____________。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是_____________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式___________________________________。
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为___________(填化学式),该实验________(填“能”或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为____________________,现象b为______________,则猜想Ⅱ成立。
(4)若用PH试纸测定操作①所得无色溶液的PH,操作方法为____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为鉴别NaCl溶液和Na2CO3溶液,甲、乙、丙三位同学设计方案如下:
甲 | 乙 | 丙 | |
实验操作 | 分别滴加酚酞试液
| 分别滴加______溶液
| 分别滴加BaCl2溶液
|
现象与结论 | 呈____色的是Na2CO3溶液,无色的是NaCl溶液 | 冒气泡的是Na2CO3溶液,无明显现象的是NaCl溶液 | 有____的Na2CO3溶液,无明显现象的是NaCl溶液 |
丙同学实验后将两只试管中的物质倒入洁净烧杯,静置后取上层清液,滴加稀硫酸观察到 ______,可知上层清液中含有BaCl2,为避免可溶性钡盐引起水体重金属污染,可向废液中加适量_______再排放。
A.碳酸钠溶液 B.硫酸钠溶液 C.硝酸银溶液 D.水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图所示的仪器或装置,回答问题。
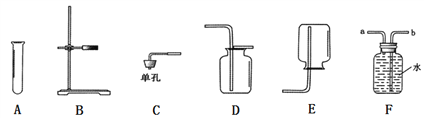
(1)若用氯酸钾和二氧化锰制取氧气,必须再增加的一种玻璃仪器是___,若用装置F收集氧气,氧气应从__(填“a”或“b”)端通入,该反应的化学方程式为___,反应的基本类型是________反应。
(2)若要组装一套二氧化碳的发生和收集装置,可选择的装置组合为______。(填写字母)
(3)若将F装置中的水换成适量的石灰水,可用于二氧化碳的检验,反应的化学方程式为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学课外活动小组欲将含可溶性杂质和少量泥沙的CaCl2固体进行提纯,得到纯净的CaCl2固体。
(1)欲除去泥沙,得到较为纯净的CaCl2固体,应采取的实验步骤是:①________; ②_______;③ 蒸发。
(2)上述三步操作都要用到的玻璃仪器是:________。(填仪器名称)
(3)经实验证实所含可溶性杂质为NaCl,现欲去除该杂质,将进行下列操作。
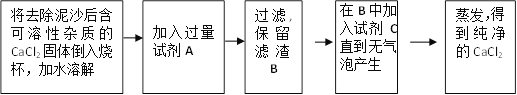
根据以上流程图,回答下列问题:
①请写出A、B、C三种物质的化学式:A___________ ;B___________ ;C___________
②写出加入过量试剂A的目的是_____________________
③写出加入过量试剂A的化学反应方程式:___________________________
④实验中称得滤渣的B的质量为5g,试计算蒸发后得到纯净CaCl2的质量是 _______ g。(精确到0.1 g)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工业废液中含有AgNO3、Zn(NO3)2和Fe(NO3)2。现要回收银,并得到副产品FeSO4·7H2O,基本流程如下:

(1)操作1所用玻璃仪器有:烧杯、玻璃棒、_______;操作3包括:蒸发浓缩、________、过滤、洗涤、干燥等。
(2)确认固体Ag被洗干净的操作是:向最后一次洗涤后的滤液中滴入______溶液,无现象。
(3)该流程有关说法正确的是___________。
a.过量X是锌 b.操作2、操作3玻璃棒作用相同 c.溶液B中的溶质是2种
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
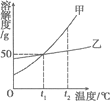
A. t1℃时,两物质的溶解度相等,均为50
B. t1℃时,等质量的甲、乙溶液中含有溶质的质量相等
C. t2℃时,无法配制出溶质的质量分数为30%的乙溶液
D. t2℃时,给甲、乙两种物质的饱和溶液(不含未溶物)分别恒温蒸发等质量的水,析出晶体的质量一定是甲大于乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯在生产、生活中广泛存在。氯元素的相关信息如图所示。请回答下列问题:
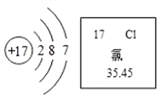
![]() 氯元素位于第______周期。
氯元素位于第______周期。
![]() 氯原子的最外层电子数为______,易得到______个电子,转化成______
氯原子的最外层电子数为______,易得到______个电子,转化成______![]() 用离子符号表示
用离子符号表示![]() 。
。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为A、B、C三种固体物质的溶解度曲线。

(1)三种物质的溶解度关系为B>A>C时的温度为 t ℃,则t的取值范围是________。
(2)在t3℃时,10 g水最多能溶解3 g B物质,则10 g水最多能溶解A物质的质量_______3g(选填“>”“<”或“=”)。
(3)将A、B、C饱和溶液从t3℃降温到t1℃时,溶质质量分数保持不变的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com