
【题目】如图所示,在白色点滴板16的孔穴中,分别滴加2滴紫色石蕊溶液。
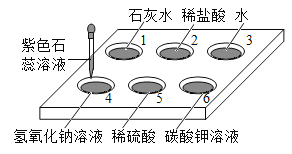
(1)孔穴6中溶液变为蓝色,说明碳酸钾溶液显____________(填“酸性”或“碱性”)。
(2)溶液变为红色的孔穴有________________(填孔穴序号,下同)。
(3)作为空白对照实验的孔穴是___________。
(4)在做酸碱中和实验时,经常会设计以下实验操作。在图示操作中,错误的是___________(填序号)。
a.稀释浓硫酸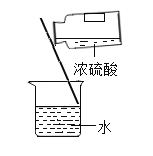 b.倾倒氢氧化钠溶液
b.倾倒氢氧化钠溶液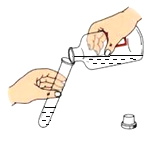 c.滴加酚酞试液
c.滴加酚酞试液
【答案】碱性 2、5 3 c
【解析】
(1)紫色石蕊试液遇碱变蓝,溶液变为蓝色,说明碳酸钾溶液显碱性;
(2)紫色石蕊试液遇酸变红,稀盐酸和稀硫酸在水溶液中电离时产生的阳离子都是氢离子,属于酸,都能使溶液变为红色,故填:2、5;
(3)1、2、4、5、6溶液中都含有水,故作为空白对照实验的孔穴是3,水不能使紫色石蕊试液变色,而其他溶液能使紫色石蕊试液变色,说明起作用的不是水,而是实验药品,故填:3;
(4)a、稀释浓硫酸:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,使热量尽快的散发出去,图中操作正确,不符合题意;
b、倾倒氢氧化钠溶液时,瓶塞要倒放在桌面上,细口瓶要紧挨着试管口,缓慢地倒,细口瓶贴标签的一面要朝向手心处,倒完液体,立即盖紧瓶塞,将瓶子放回原处,图中操作正确,不符合题意;
c、胶头滴管加液时,既不能伸入容器,更不能接触容器,应垂直悬空于容器上方0.5cm处,图中操作错误,符合题意。
故选c。


科目:初中化学 来源: 题型:
【题目】小亮同学发现实验室利用红磷燃烧测定空气中氧气含量,实验结果并不准确。为什么呢?
(进行猜想)(1)装置漏气;
(2)____________,导致装置内有氧气剩余。
(实验与交流)在老师的指导下,小亮分别用过量的红磷和白磷进行实验,用测氧气浓度的传感器测得反应后装置内氧气的浓度分别为8.84%和3.21%,请问产生上述结果的原因可能是:________________。
(再探究)小亮查阅资料发现铁粉在潮湿的空气中易生锈(Fe2O3﹒xH2O),利用铁粉、活性炭、氯化钠等物质又进行了实验(如图),实验后测得的数据如下表:
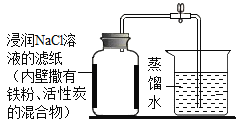
实验前体积 | 实验后体积 | |
集气瓶内空气 | 烧杯内蒸溜水 | 烧杯内剩余蒸溜水 |
131mL | 90.0mL | 63.6mL |
计算出空气氧气体积含量为________(计算结果保留一位小数)
(结论与反思)通过上述实验探究,选择 _________(填物质名称)进行实验,可减小实验误差。
(拓展延伸)铜也能与空气中的氧气、水、二氧化碳反应而锈蚀生成铜绿[主要成分为Cu2 (OH)2CO3],若将上图实验中的铁粉换成铜粉进行实验,请判断能否较准确的测定空气中氧气的含量,并说明理由:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120°C下发生反应,反应微观模型如图所示。

(1)金原子对____(填“CO”或“H2O”)起吸附催化作用。
(2)发生反应的化学方程式为___。此反应过程中元素化合价不变的是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图是木炭在氧气中燃烧实验的操作示意图,请回答下列问题:
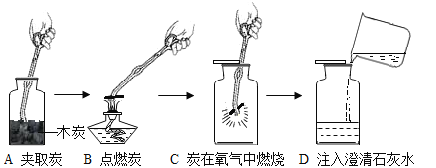
(1)取用木炭的仪器叫_____,未经点燃的木炭_____(填“能”或“不能”)在氧气中燃烧。
(2)把红热的木炭插入盛有氧气的集气瓶时,现象是_____,反应的文字表达式_____,老师告诉我们说,实验时,木炭应该由上向下缓慢插入,理由是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图为氯化钠、硫酸镁和硝酸钾的溶解度曲线.请回答:
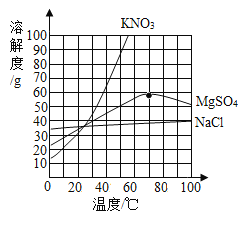
(1)40℃时,向100g水中加入50g硝酸钾,所得溶液为____溶液(填“饱和”或“不饱和”).
(2)由图中获得有关硫酸镁的溶解度随温度变化的规律是____.
(3)60℃时,将氯化钠和硝酸钾分别加入100g水中各配成饱和溶液,再冷却到10℃,则装____(填“氯化钠”或“硝酸钾”)溶液的烧杯析出的晶体较多.
(4)若将50g质量分数为20%的氯化钠溶液稀释为10%的氯化钠溶液,应加水的质量是____g.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中应用广泛,其构造如图1。
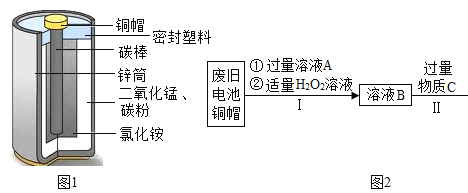
(1)根据图1判断,属于金属材料的有铜帽和_________。
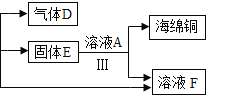
(2)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到ZnSO4溶液,主要流程如图2。
己知:![]()
①写出过程II中生成金属单质的化学方程式:_____________________。
②过程Ⅲ中加入溶液A充分反应后,还需进行的主要操作是_______。
③下列说法正确的是______(填标号)。
a过程I中H2O2也有可能分解生成氧气
b固体E是混合物
c溶液B中含有2种阳离子
(3)将一定质量的铁粉加入到Zn(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是____(填字母)。
a若滤液为蓝色,则滤渣中一定有银,可能有铜
b若滤渣中含有银、铜、铁,则滤液中一定含有Zn2+、 Fe3+、NO3-
c若滤液为浅绿色,则滤渣中一定含银、铜、铁
d若滤渣中加稀盐酸无气泡产生,则滤液中一定有Zn2+、 Fe2+、 Cu2+,可能有Ag+
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是人类宝贵的自然资源。
(1)天然水中含有许多杂质,实验室常用过滤方法除去水中不溶性杂质,过滤需要用到的仪器有带铁圈的铁架台、烧杯、漏斗和 (填仪器名称)。
(2)硬水给生活和生产带来很多麻烦,生活中常用 的方法降低水的硬度。
(3)氯气可用作自来水的消毒剂,实验室制取氯气的化学方程式为:
MnO2+4HCl(浓)![]() X+Cl2↑+2H2O,X的化学式为 。
X+Cl2↑+2H2O,X的化学式为 。
(4)在电解水的实验中,两电极相连的玻璃管上方产生的气体是氧气和氢气,一段时间后,氧气和氢气的体积比约为 。
(5)甲和乙两种固体物质的溶解度曲线如图所示。
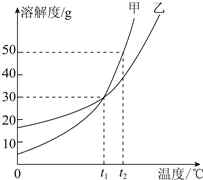
①t1℃时,甲和乙的溶解度 (填“相等”或“不相等”)。
②t2℃时,甲和乙的饱和溶液各100g,两种溶液中溶剂的质量大小关系为:甲 乙(填“>”、“=”或“<”)。
③将t2℃时150g甲的饱和溶液降温至t1℃,所得溶液中溶质的质量分数为 (计算结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
(实验探究1)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体于试管中,溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含_____和氢氧化钙 |
(2)另取少量固体于试管中,滴加足量的_____ | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有______,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | _______ | 固体中一定含有CaCO3 |
(实验质疑)
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_________。
(2)丙同学认为甲同学的实验并不能得出一定不含FeO3的结论,理由是_________。
(实验探究2)乙、丙同学设计如下实验方案继续验证:
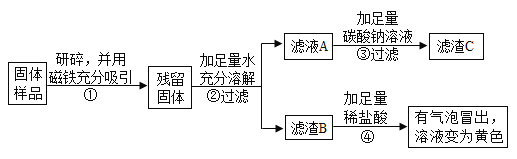
(1)乙、丙同学实验中又能得出固体样品中一定还含有_______,仍有一种物质不能确定,该物质是_______。
(2)乙、丙同学又经过实验测得上述3.9g残留固体中含钙物质的总质量为2.3g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为2.0g。
(实验结论)综合上述实验及所给数据:
(1)判断久置固体的成分是_______。
(2)计算上述残留固体中氧化钙的质量的质量为______克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______。
(2)铜在工业上可用于生产电缆(外面包裹了电缆皮),这是利用了铜的_____性。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
![]()
(1)含铜废料粉碎的目的是__________。
(2)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为_____。
(3)兴趣小组同学一致指出,将滤液经蒸发浓缩、_____(填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是____________。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
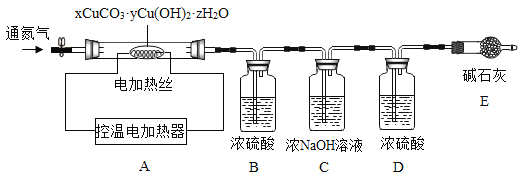
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.4 | 100.2 | 120.5 |
实验分析和数据处理
(1)实验前应该先_________,再鼓入一段时间氮气后称量B、C、D、E的质量。
(2)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______时表明碱式碳酸铜已经完全分解。
(3)反应结束后,再缓缓鼓入一段时间氮气的目的是___________。
(4)该碱式碳酸铜的化学式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com