
����Ŀ������֪ʶ��Լ��Դ ������������������������й㷺��Ӧ�á���ش��������⣺
��1����˿��������������еĵ�˿�������˸ý���____________�����ʡ� ����˿��Ǧ��Ͻ𣩱�������Ĵ��������۵�_____________��ѡ��������������������
��2����ͼ��ʾװ����̽���������ʵ�飬ʵ��������Ƭ��״����С��ͬ��������д�ո�
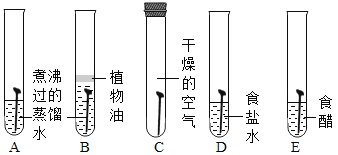
��һ��ʱ����Թ� A ����Ƭ���⣬�Թ� B �� C ����Ƭ���ֹ������Թ� D �� E ����Ƭ���ⶼ���Թ�A�ࡣȫ��۲��Թ� ABC ���������������ó����ۣ�������ʴ��Ҫ����������е�_____________��ͬ���õĽ����
�ڶԱ��Թ� A��E ����ʵ������ǣ�___________��
�������к��߱Ⱥӱߵ�����Ʒ���������⣬�Ӷ��²��Ȼ����ܼӿ�������ʴ��Ϊ��֤���룬Ӧ����ʵ����_______��ѡ���Թܱ�ţ���
��3���ҹ�ÿ�걨�ϵ��ֻ����� 1 �ڲ����Ͼ��ֻ��ĵ�·���к���ͭ����������������ȶ��ֽ��������ⶪ���Ȼ������Դ�˷ѣ�Ҳ����Ⱦ������ˮ�塣��ѧС��Ϊ�������е�ͭ����Ʋ�����������ʵ�顣��֪�� Cu+H2O2+H2SO4=CuSO4+2H2O�������ǽ����������Ʒ�Ӧ��

��д��һ��������з�����Ӧ�Ļ�ѧ����_____________��
����Һ A �е���������_____________����д���ӷ��ţ���
����Һ C ��һ�����е�������_____________��
���𰸡��۵�� �� ������ˮ ��������ڵĻ����и������� AD Fe+H2SO4�TFeSO4+H2����2Al+3H2SO4�TAl 2(SO4)3+3H2�� Al3+��Fe2+��H+ H2SO4 H2O2 CuSO4
��������
��1����˿��������������еĵ�˿�������˸ý����۵�ߵ����ʣ��Ͻ���۵�һ���������ɴ��������۵㣬����˿��Ǧ��Ͻ𣩱�������Ĵ��������۵�͡�
��2����A�Թ�������������ˮ��ͬ�Ӵ���B�Թ�ֲ�����赲����������е������Ӵ���C�Թ���������ˮ�Ӵ���ȫ��۲��Թ� ABC �����������Թ� A ����Ƭ���⣬�Թ� B �� C ����Ƭ���ֹ�����˵����������Ҫ����������е�������ˮ��ͬ���õĽ����
��A�Թ�������������ˮ��ͬ�Ӵ���E�Թ���������ᡢˮ�������Ӵ����Թ� A ����Ƭ���⣬�Թ�E ����Ƭ������Թ�A�ࡣ˵����������ڵĻ����и������⡣
��A�Թ�������������ˮ��ͬ�Ӵ���D�Թ��������Ȼ��ơ�ˮ�������Ӵ����Թ� A ����Ƭ���⣬�Թ�D ����Ƭ������Թ�A�ࡣ˵�������Ȼ��ƴ��ڵĻ����и������⡣ͨ��AD����ʵ��ȽϿ�֪�����к��߱Ⱥӱߵ�����Ʒ���������⣬�Ӷ��²��Ȼ����ܼӿ�������ʴ��
��3���ٲ����������ϡ���ᷴӦ����������������������ѧ����ʽ��Fe+H2SO4�TFeSO4+H2����ϡ���������Ӧ������������������2Al+3H2SO4�TAl 2(SO4)3+3H2����������ͭ��ϡ�����Ӧ��
��ϡ���������Ӧ��������������������ϡ���������Ӧ����������������������������ǹ����ģ�������ҺA�е���������Al3+��Fe2+��H+��
��������B�����н�����ͭ���м�������ϡ�������������Һ������Cu+H2O2+H2SO4=CuSO4+2H2O��ͭ������Ӧ����Ӧ����ˣ���Һ C ��һ�����е������ǹ�����H2SO4�� H2O2�ͷ�Ӧ���ɵ�����ͭ��


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������и�ͼ�е��й���Ϣ���ش��������⣺
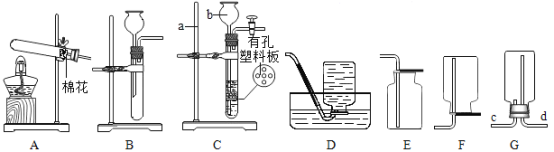
��1������b�����ƣ�_____��
��2��ʵ������װ��A��ȡ����ʱ������Ӧ�Ļ�ѧ����ʽ��_____����Ҫ�ռ����ϴ�����������Ӧѡ�õ��ռ�װ����_____������ĸ����
��3��ʵ������ȡ������̼�Ļ�ѧ����ʽΪ_____������Gװ���ռ�CO2���壬����Ӧ��_____�ˣ��c����d�������롣
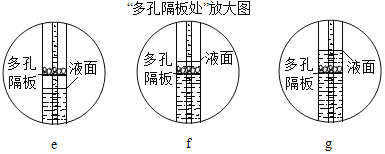
��4������Cװ����ȡCO2����װ�õ��ŵ���_____���رտ��غ�C�ж���崦���ι۲쵽��������_____������ĸe��f��g����ͼ��������
��5��ij�о�С���H2O2�ֽ�ĸ��ִ����Ĵ�Ч�����ж����Ա�̽����С����Աѡ�ú������ƣ�����������һ����Ȼ�߷������ʣ��ڱ�ʵ���������ȶ�����Ϊ����֧�ܣ��Ʊ����ز�ͬ�����ĺ����������������ֻ��ֳּ���չ��̽����
��ʵ����̣�
I���Ʊ����ָ��ز�ͬ������MnO2��Cr2O3��Fe2O3��CuO��S���ĺ���������ÿ�����С��ͬ���Ҹ��ش�����������ȡ�
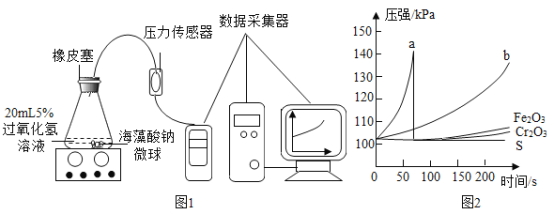
II��ȡ30������ij�ִ����ĺ�����������20mL��������Ϊ5%�Ĺ���������Һ������ƿ��Ѹ�ٻ�Ϸ�����Ӧ��ʵ��װ����ͼ1���ɼ�200s��ѹǿ���ݣ�����������ͼ2��
��ʵ�������
�ٱ�ʵ���У�����MnO2������ʾ�����õĴ�Ч����ͼ2�ж�Ӧ��������_____���a����b������д�������߶�Ӧ�Ļ�ѧ����ʽ_____��
��aƿ��60������ʱѹǿͻȻ�ָ�����ѹ�������ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڶ�����������Դʮ�ַḻ���Ӻ�ˮ����ȡ�Ȼ��Ʋ����Ȼ��ƺ�ˮΪԭ����ȡ�������ơ����������ʵĹ�������ͼ���£�
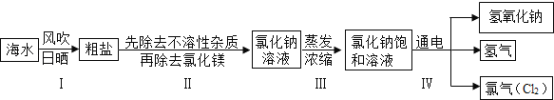
ij��ȤС���������ʵ�飺
��ʵ��һ����ȥ�����еIJ���������
����һ����������ƽ��ȡ5.0g���Σ���ҩ���ô�������ʢ10mLˮ���ձ��У��ӱ��ò��������裬һֱ�ӵ����β����ܽ�Ϊֹ������ʣ�µĴ�������Ϊ1.4g
��������������ˡ��������õ�3.2g���Σ�
��1�����㾫�εIJ���_________������һλС������
��2����С���õIJ���ƫ�ͣ����ܵ�ԭ����________��
A�ܽ�ʱδ��ֽ���
B����ʱˮ��δ����
C����ʱ��������������
��3������һ�����IJ��ֲ�����ͼ��ʾ�����д������_________������ĸ��ţ���
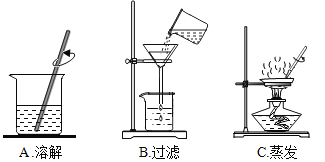
��ʵ�����̽����������ͼ���������õ��Ȼ�����Һ��MgCl2�Ƿ��������Һ���Ƿ���CaCl2
[��������]�й����ʵ��ܽ��Ա���20����
������ | OH�� |
|
Ca2+ | | �� |
Mg2+ | �� | |
[����ʵ��]���������ǹ�ͬ��ɣ����ش����������⣺
ʵ�鲽�� | ʵ������ | ʵ����� |
����һ��ȡһ�������Ȼ�����Һ���Թ��У�����������NaOH��Һ | ���������� | ˵��MgCl2______��������������δ�������� |
�������������һ������Һ�м���������______��Һ | ������ɫ���� | ˵����Һ�к���CaCl2 |
[��չ˼ά]
��1����������ͼ�������Ӻ�ˮ�еõ����Σ����÷紵��ɹ�����ܼ��ķ����������Dz��ý�����Һ�¶ȵķ�����ԭ����________________________________��
��2��д����������ͼ�������Ļ�ѧ����ʽ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ�����������ĺ�����ij��ȤС���ͬѧѡ����40mL���Թ�����Ӧ��������ͼ������������㹻������Ч���ܺõ���Ͳע�������������İ��ף��仯ѧ������������ƣ�40��ʱ�Ϳ���ȼ�գ������Թܺ�����Ƥ�������Թܣ����н����ɼУ��þƾ��Ƽ��Ȱ��ף�ȼ�ս����ȵ��Թ���ȴ���ɿ����ɼУ��۲�����
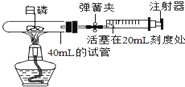
��1����ʽ��ʼʵ��ǰ������ȤС��ͬѧ���ɼУ���ע����������20ml�̶ȴ�����15ml����Ȼ���ɿ��������۲쵽����������20ml�̶ȴ����ò�������ҪĿ���� ��
��2��ʵ���У����ɿ����ɼ�ǰ�����Թ��п��Թ۲쵽����ȼ�շ�����ɫ���棬������ ��
��3��ʵ����Թ۲쵽��Ͳ�������ԭ����20mL�̶ȴ����������Ƶ�Լ�� ������
A��4mL�̶� | B��8mL�̶� | C��12mL�̶� | D��16mL�̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��廷ͼ�е�ÿ�����������л�ѧ�г�����һ�����ʣ����Ƿֱ����ڵ��ʡ�������ᡢ����е�һ �֡������ཻ��ʾ����֮�������Ӧ�����б����в������������
A.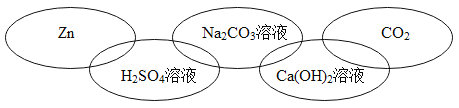 B.
B.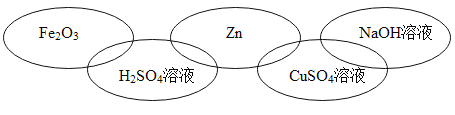
C.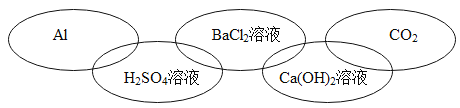 D.
D. 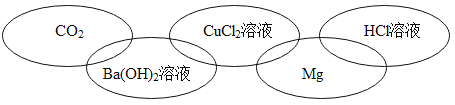
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǹ�������R��ˮ���ƾ������ܼ��е��ܽ�����ߡ�����˵��������ǣ� ��
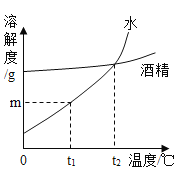
A.R��ˮ�е��ܽ�����¶�Ӱ��ϴ�
B.t1 ��ʱ��R��ˮ�е��ܽ��Ϊm g
C.t2 ��ʱ��R��ˮ�����ھƾ��е��ܽ�����
D.R�ı���ˮ��Һ��t1 ��������t2 ��ʱ���о�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ҹ���ѧ�Һ�°����������Ƽ�����������Na2CO3������ƷNH4Cl�Ĺ����������£�ע��NH4Cl���ܽ�����¶ȵ�Ӱ��ϴ������¶ȵ����߶�����
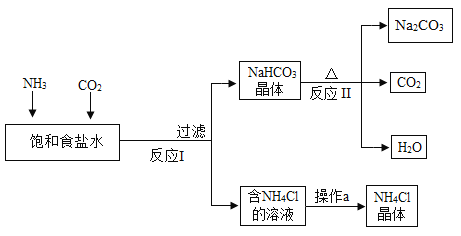
��1���������������п�ѭ�����õ�������_______��
��2������a�Ĺ���������Ũ����_______�����ˡ�
��3��д����Ӧ��Ļ�ѧ����ʽ_______��
��������ͼ��ʾA��H���ʼ��ת����ϵ����֪A��C��F�ǵ��ʣ�D��E�����Ԫ����ͬ�����������H��Һ����ɫ������������Ԫ����ɣ�G�dz��������Ҫ�ɷ֡�
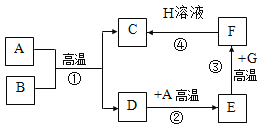
��1��A��H�ֱ���_______��_______���ѧʽ����
��2���١����У������û���Ӧ����_______������ţ������ڻ��Ϸ�Ӧ����_______������ţ�����Ӧ�۵Ļ�ѧ����ʽΪ_______��
��3����Ƭ״�Ĺ���F����H��Һ�У��ɹ۲쵽��������_______��
��4���о�D�����������е�һ����;_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥNaCl��Һ�к���������MgCl2��CaCl2��Na2SO4�����ʣ�ijС��ͬѧѡ��Na2CO3��Һ��ϡ���ᡢBa��OH��2��Һ�����Լ�����һ����˳�������ͼ��ʾ��ʵ�顣
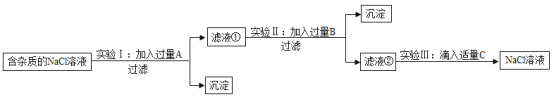
�ش��������⣺
��1��ʵ�����м����Լ�A��ȥ��������_________��
��2��ʵ�����м�����Լ�B��_________��Һ���������B��Ŀ����__________��
��3����Һ���г�Na+��Cl-�⣬�����е�������__________�������ӷ��ţ���
��4��ʵ�����з������кͷ�Ӧ�Ļ�ѧ����ʽ__________��
��5��������NaCl��Һ�Ƴ��Ȼ��ƾ��壬�������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݸ�����Ԫ�����ڱ��в���ԭ�ӵĽṹʾ��ͼ���ش��������⡣
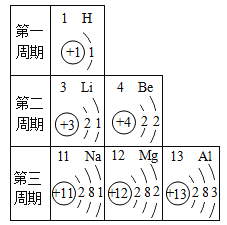
��1��ԭ������Ϊ 20 ��Ԫ������Ϊ____________��
��2���ڻ�ѧ��Ӧ�У�Mg2+���� ____________�����ӱ��þԭ�ӣ�
��3����ԭ�ӵĽṹʾ��ͼΪ____________���Ʋ���Ԫ��Ӧ���� ��__________���ڡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com