
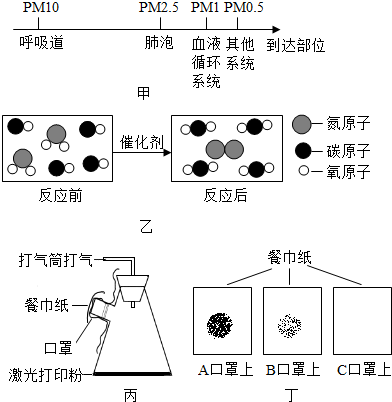
分析 (1)从非特异性免疫(又称先天性免疫)和特异性免疫的特点去分析解答;
(2)A、从该反应中构成反应物的原子重新组合成新物质的分子去分析解答;
B、从置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应去分析解答;
C、从反应的化学方程式可以看出:NO2和CO气体转化为N2和CO2去分析解答;
(3)从口罩的过滤效果去分析解答.
解答 解:(1)免疫系统包括三道防线,非特异性免疫是指第一道和第二道防线.
第一道防线是由皮肤和黏膜构成的,他们不仅能够阻挡病原体侵入人体,而且它们的分泌物(如乳酸、脂肪酸、胃酸和酶等)还有杀菌的作用. 第二道防线是体液中的杀菌物质和巨噬细胞.这两道防线是人类在进化过程中逐渐建立起来的天然防御功能,特点是人人生来就有,不针对某一种特定的病原体,对多种病原体都有防御作用,因此叫做非特异性免疫(又称先天性免疫). 第三道防线主要由免疫器官(胸腺、淋巴结、骨髓、和脾脏等)和免疫细胞(淋巴细胞)组成的.第三道防线是人体在出生以后逐渐建立起来的后天防御功能,特点是出生后才产生的,只针对某一特定的病原体或异物起作用,因而叫做特异性免疫;故答案为:非特异性;
(2)由题目中图可以得出反应的化学方程式为:2NO2+4CO$\frac{\underline{\;催化剂\;}}{\;}$N2+4CO2;
A、该反应中构成反应物的原子重新组合成新物质的分子;故A正确;
B、置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应,而在这个反应中反应物两种都是化合物;故B错误;
C、由上面的化学方程式可以看出:NO2和CO气体转化为N2和CO2;故C正确;
故答案为:AC;
(3)由图可以看出C口罩的过滤效果最好,故答案为:C.
点评 生活处处有化学,学会用所学的化学知识,解决生活中的实际问题.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:初中化学 来源: 题型:实验探究题
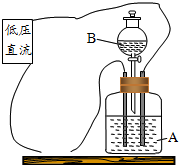 如图是试验物质导电性的装置,瓶中装的一种pH值大于7的溶液A,在连接低压直流电源后,灯泡发光,然后把分液漏斗中的溶液B慢慢注入瓶中,灯泡光亮逐渐变暗,到完全熄灭;继续慢慢注入溶液B,灯泡又逐渐恢复发光.根据上述的变化现象推断:溶液A中的溶质是氢氧化钡,溶液B中的溶质可能是硫酸或硫酸镁.
如图是试验物质导电性的装置,瓶中装的一种pH值大于7的溶液A,在连接低压直流电源后,灯泡发光,然后把分液漏斗中的溶液B慢慢注入瓶中,灯泡光亮逐渐变暗,到完全熄灭;继续慢慢注入溶液B,灯泡又逐渐恢复发光.根据上述的变化现象推断:溶液A中的溶质是氢氧化钡,溶液B中的溶质可能是硫酸或硫酸镁.查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 把溶剂蒸发掉一半 | |
| B. | 加入40g溶质质量分数为15%的CaCl2的溶液 | |
| C. | 把溶剂蒸发掉15g | |
| D. | 加入2gCaCl2固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH═A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀.
Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH═A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| a.取少量红色固体加入到足量硫酸溶液中 | 无明显现象 | 假设成立假设一 |
| b.取少量红色固体加入到足量硫酸溶液中 | 有红色固体剩余 | 假设二和假设三均成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com