
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 做空气中氧气含量测定的实验装置如右图.
做空气中氧气含量测定的实验装置如右图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
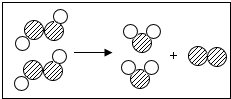 如图为某反应的微观示意图,不同的球代表不同幸免于难的原子,下列说法中错误的是( )
如图为某反应的微观示意图,不同的球代表不同幸免于难的原子,下列说法中错误的是( )| A. | 该反应的反应物可能属于氧化物 | |
| B. | 不考虑反应条件时,该图示可以表示双氧水制取氧气的反应 | |
| C. | 该反应类型为分解反应 | |
| D. | 该反应前后元素的个数没有改变,分子的种类改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
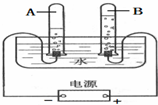 如图是电解水的实验装置图.电解水的反应符号表达式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,该反应属于基本反应类型中的分解反应.通过此实验说明水是由氢、氧两种元素组成的,同时也进一步说明在化学反应中,分子可以分解为原子,原子不能再分,只能重新组合.电解水一段时间后,试管B中收集到的气体是氧气,若B试管中最终收集到10mL气体,则A试管中最多可收集到20mL的气体.
如图是电解水的实验装置图.电解水的反应符号表达式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,该反应属于基本反应类型中的分解反应.通过此实验说明水是由氢、氧两种元素组成的,同时也进一步说明在化学反应中,分子可以分解为原子,原子不能再分,只能重新组合.电解水一段时间后,试管B中收集到的气体是氧气,若B试管中最终收集到10mL气体,则A试管中最多可收集到20mL的气体.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
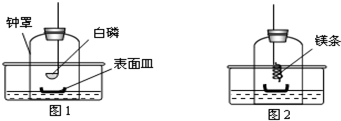
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com