
【题目】如图是测定空气中氧气含量的实验装置。下列说法正确的是( )
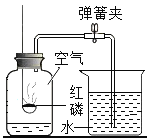
A. 此实验不是制取气体,所以实验前不用检查装置的气密性
B. 实验前没有将弹簧夹夹紧,会导致测定结果偏高
C. 该实验可以说明空气中含有稀有气体
D. 若把红磷换成木炭,也可得到相同实验结果
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:初中化学 来源: 题型:
【题目】氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如下:
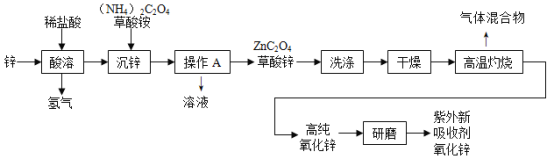
(1)推测草酸的化学式是_____;
(2)“沉锌”过程中发生复分解反应,反应的化学方程式是_____;
(3)“操作A”的名称是_____。
(4)“高温灼烧”时草酸锌分解,生成物都是氧化物,反应的化学方程式是_____。
(5)判断是否洗涤干净?往最后的洗出液中加入_____溶液,若无白色沉淀出现,则说明洗涤干净。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠是一种重要的资源,在海水中储量很丰富。回答问题:
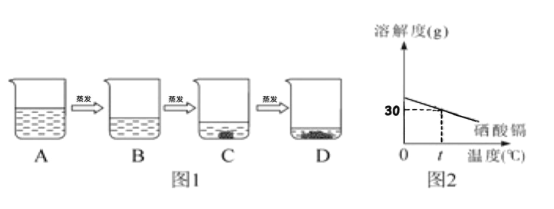
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程, 用氯化钠溶液模拟该过程 (如图1所示)。已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是___(填字母序号,下同),与B溶液中溶质的质量分数相等的溶液是___.
(2)图2为硒酸镉的溶解度曲线。t ℃时,将15g硒酸镉加入____g水中,完全溶解后,恰好得到饱和溶液。要进一步提高硒酸镉溶液中溶质的质量分数,进行的操作是_________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图,下列叙述正确的是( )
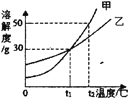
A. t2℃时,甲的溶解度为50
B. 乙中含有少量甲,可用蒸发溶剂的方法提纯甲
C. t2℃时,将甲、乙饱和溶液降温到tl℃,所得溶液中溶质的质量分数相等
D. ti℃时,等质量的甲、乙饱和溶液,升温到t2℃,分别加入20 g的甲、乙,一定可以得到甲、乙的饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,A、B、C、D、E分别是初中化学常见的不同类别的物质,X是人体内含量最高的物质,A用于配制波尔多液。(用“一”表示两种物质能发生反应,用→” 表示一种物质能转他为另一种物质,用“←→”表示两种物质能互相转化,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)
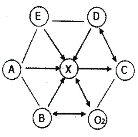
(1)写出D、E物质的化学式:④D.____;②E._________________________;
(2)A与B反应的化学方程式为___________________:
(3)氧化铁与过量D反应的实验现象为___________
(4)在图中补充通过化合反应实现的一个转化关系和一个反应关系___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】25℃时,向盛有等质量的甲、乙、丙三种固体的试管中,分别加入等量的水,充分溶解后,甲、乙还有剩余,丙全部溶解。然后将三支试管加入盛有80℃水的烧杯中,甲没有明显变化,乙全部溶解,丙有固体析出。如图1所示。请回答:
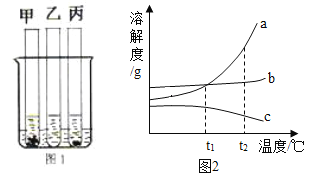
(1)烧杯里的三个试管中,_____(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。
(2)图2中能表示丙物质的溶解度曲线的是_____(选填“a”、“b”或“c”)。
(3)t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中,水的质量最少的是_____(选填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过下列实验现象,能说明氢氧化钠与稀硫酸发生了化学反应的是( )
A. 在稀硫酸中加入一定量的氢氧化钠固体,用温度计测得溶液的温度显著升高
B. 在![]() 的氢氧化钠溶液中加入一定量的稀硫酸,用pH计测得溶液的pH值变为8
的氢氧化钠溶液中加入一定量的稀硫酸,用pH计测得溶液的pH值变为8
C. 在氢氧化钠溶液中先滴加无色酚酞,再逐滴加入稀硫酸,看到酚酞红色逐渐变浅
D. 在氢氧化钠溶液中先加入一定量的稀硫酸,再逐滴加入硫酸铜溶液,无明显现象
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4 ·7H2O),其工艺流程如下:

查阅资料:SiO2不溶于水,也不与稀硫酸反应。
⑴ “浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+H2O、__________________。
⑵ 过滤用到的玻璃仪器有______________。
⑶ “还原”步骤是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
① 若试剂X是SO2,转化原理为SO2+Fe2(SO4)3+2H2O=2FeSO4+2Y,则Y的化学式是:____________。
② 若试剂X是Fe,转化原理的化学方程式为______________________。
测得“还原”后溶液的pH明显增大,其原因是______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国在2017年“世界环境日”(6月5日)确定的主题是“绿水青山,就是金山银山”.华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是______g.
(2)污水中所含NaOH的质量分数是___________?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸______克才能使碳酸钠恰好完全变成硫酸钠.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com