
| A. | m/12n | B. | mn/12 | C. | 12n/m | D. | m/n |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 对比实验是科学探究运用最多的方法之一,下列是几个对比试验:
对比实验是科学探究运用最多的方法之一,下列是几个对比试验:| 序号 | 实验1 | 实验2 | 实验3 |
| 实验目的 | 比较氯气和空气的部分物理性质 | 二氧化碳的化学性质比较 | |
| 实验装置图 | 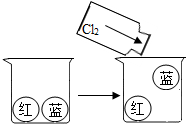 |  |  |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 此装置的能量转化是化学能转化为电能 | |
| B. | 试管a、b中气体的质量比约为2:1 | |
| C. | 试管a中的气体能使带火星的木条复燃 | |
| D. | 该实验可证明水是化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 净化后的空气、二氧化硫 | |
| B. | 液氮、啤酒 | |
| C. | 生锈的铁钉、高锰酸钾加热后的剩余固体 | |
| D. | 氯化钾、五氧化二磷 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 除去CaO中混有的CaCO3,先加足量水,然后过滤 | |
| B. | 除去MnO2粉末中混有的KCl,先加足量水溶解、过滤,然后洗涤、干燥 | |
| C. | 用紫色石蕊试液鉴别稀盐酸和稀硫酸 | |
| D. | 用碘化钾检测食品中是否含有淀粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操作 | 实验现象 | 原理或解释 | |
| 取 甲 酸 溶 于 水 | 滴加紫色石蕊 | 溶液变成红色 | 溶液中含氢离子 |
| 加适量的锌粒 | 观察到有气泡冒出 | 2HCOOH+Zn═(HCOO)2Zn+H2↑ | |
| 加氧化铁粉末 | 观察到红棕色固体消失,溶液变成黄色 | 甲酸可以与金属氧化物反应,工业上 可用甲酸除锈 |
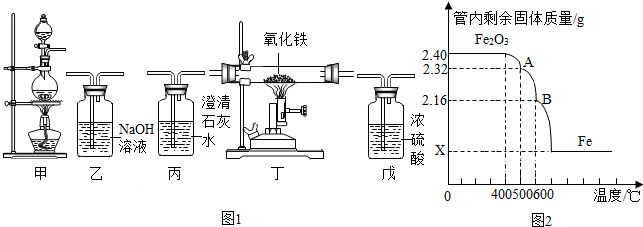
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com