
| 操作 | 实验现象 | 原理或解释 | |
| 取 甲 酸 溶 于 水 | 滴加紫色石蕊 | 溶液变成红色 | 溶液中含氢离子 |
| 加适量的锌粒 | 观察到有气泡冒出 | 2HCOOH+Zn═(HCOO)2Zn+H2↑ | |
| 加氧化铁粉末 | 观察到红棕色固体消失,溶液变成黄色 | 甲酸可以与金属氧化物反应,工业上 可用甲酸除锈 |
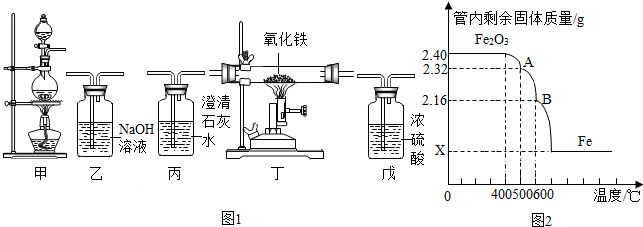
分析 【查阅资料】浓硫酸在甲酸分解反应中起脱水作用;
【实验设计及操作】
I.根据酸的性质分析
Ⅱ.①实验之前先检查装置的气密性.根据甲酸(HCOOH)是无色易挥发的液体,制取的一氧化碳(甲装置)中可能含有甲酸,用乙装置处理,再干燥(戊装置),通入反应装置(丁),处理二氧化碳(丙)再进行尾气处理;进行解答;
②根据一氧化碳还原氧化铁实验主要步骤为:(一)先通入一氧化碳一段时间(目的是排尽玻璃管内的空气,防止加热时玻璃管内的一氧化碳与空气的混合气体发生爆炸);(二)点燃酒精喷灯给氧化铁加热;(三)熄灭酒精喷灯,继续通一氧化碳直至装置冷却(防止刚生成的铁在高温下又与氧气反应,使实验失败);(四)停止通入一氧化碳.进行解答;
根据甲酸是无色易挥发的液体,装置乙用来处理制取的一氧化碳可能含有甲酸,进行解答;
③装置丁中观察到的现象:红色的氧化铁粉末逐渐变为黑色;正确书写反应的化学方程式;
④根据未反应的氧化铁与盐酸反应生成氯化铁溶液,氯化铁溶液与生成的铁反应,溶液也可变为浅绿色.进行解答.
Ⅲ.根据该实验流程为:一氧化碳与氧化铁在解热的条件下,随着温度的升高,氧化铁中的氧逐渐失去,最后得到单质铁解答.
解答 解:【查阅资料】浓硫酸在甲酸分解反应中起脱水作用;
【实验设计及操作】I.甲酸溶于水能电离出氢离子,溶液显酸性,可使紫色石蕊变红.甲酸与锌粒反应产生氢气;与氧化铁反应生成甲酸铁和水,铁离子的溶液为黄色.
Ⅱ.①实验之前先检查装置的气密性.根据甲酸(HCOOH)是无色易挥发的液体,制取的一氧化碳(甲装置)中可能含有甲酸,用乙装置处理,再干燥(戊装置),通入反应装置(丁),处理二氧化碳(丙)再进行尾气处理;所以装置的连接顺序为:甲→乙→戊→丁→丙;由于一氧化碳有毒污染空气,所以应该有尾气处理装置.
②根据一氧化碳还原氧化铁实验主要步骤为:(一)先通入一氧化碳一段时间(目的是排尽玻璃管内的空气,防止加热时玻璃管内的一氧化碳与空气的混合气体发生爆炸);(二)点燃酒精喷灯给氧化铁加热;(三)熄灭酒精喷灯,继续通一氧化碳直至装置冷却(防止刚生成的铁在高温下又与氧气反应,使实验失败);(四)停止通入一氧化碳.可得:实验时先点燃甲中的酒精灯,一段时间后再点燃丁中的酒精喷灯,目的是:产生CO气体,排尽装置内的空气,防止加热爆炸;
根据甲酸是无色易挥发的液体,装置乙用来处理制取的一氧化碳中含有甲酸气体;因此装置乙的作用是:除去CO中的甲酸气体;
③装置丁中观察到的现象:红色的氧化铁粉末逐渐变为黑色;
反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 ;
④根据未反应的氧化铁与盐酸反应生成氯化铁溶液,氯化铁溶液与生成的铁反应,溶液也可变为浅绿色.
Ⅲ.①在0~400℃温度范围内,根本达不到反应所需的最低温度,所以氧化铁的质量并未改变.
故答案为:未达到反应所需的最低温度.
②从400℃开始,随着温度的升高,氧化铁中的氧开始逐渐失去,到700℃时只剩下铁,即此时氧化铁被一氧化碳还原为铁单质.
根据元素守恒,铁单质的质量=氧化铁中铁元素的质量=2.4g×$\frac{56×2}{56×2+16×3}$×100%=1.68g,
故答案为1.68.
③B处氧化物中铁的质量=氧化铁中铁元素的质量=2.4g×$\frac{56×2}{56×2+16×3}$×100%=1.68g,
B处氧化物中氧的质量=氧化铁中氧的质量-失去氧的质量=2.4g×$\frac{16×3}{160}$×100%-(2.40-2.16)g=0.48g
A处氧化物中铁与氧原子个数比=$\frac{1.68g}{56}$:$\frac{0.48g}{16}$=$\frac{1}{1}$,所以A处氧化物的化学式为FeO
故答案为:FeO
④A处氧化物中铁的质量=氧化铁中铁元素的质量=2.4g×$\frac{56×2}{56×2+16×3}$×100%=1.68g,
A处氧化物中氧的质量=氧化铁中氧的质量-失去氧的质量=2.4g×$\frac{16×3}{160}$×100%-(2.40-2.32)g=0.64g
A处氧化物中铁与氧原子个数比=$\frac{1.68g}{56}$:$\frac{0.64g}{16}$=$\frac{3}{4}$,所以A处氧化物的化学式为Fe3O4
在温度500~600℃内,丁装置中发生反应的化学方程式Fe3O4+CO$\frac{\underline{\;高温\;}}{\;}$3FeO+CO2
故答案为:【查阅资料】脱水;【实验设计及操作】I.
| 操作 | 实验现象 | 原理或解释 | |
| 取 甲 酸 溶 于 水 | 滴加紫色石蕊 | 溶液变成红色 | 溶液中含氢离子 |
| 加适量的锌粒 | 观察到 有气泡冒出 | 2HCOOH+Zn═(HCOO)2Zn+H2↑ | |
| 加氧化铁粉末 | 观察到红棕色固体消失,溶液变成黄色 | 甲酸可以与金属氧化物反应,工业上 可用甲酸除锈 |
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:选择题
| A. | m/12n | B. | mn/12 | C. | 12n/m | D. | m/n |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得虑渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末.向D试管中加入ag二氧化锰粉末,观察现象. | / |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质(少量) | 试剂和操作方法 |
| A | FeSO4溶液 | CuSO4溶液 | 加入足量铁粉,过滤 |
| B | NaCl溶液 | Na2CO3溶液 | 加入适量BaCl2溶液,过滤 |
| C | 铁粉 | 铜粉 | 加入足量稀硫酸,过滤 |
| D | CaCl2溶液 | 盐酸 | 加入足量石灰石,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲醛是一种有机化合物 | |
| B. | 甲醛分子是由一个碳原子和一个水分子构成 | |
| C. | 一个甲醛分子中含有四个原子 | |
| D. | 甲醛中C、H、O三种元素的质量比为6:1:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | a | b | c | D |
| 反应前质量/g | 4 | 6 | 111 | 4 |
| 反应后质量/g | 待测 | 15 | 0 | 84 |
| A. | c可能是单质 | |
| B. | 密闭容器中发生的变化属于化合反应 | |
| C. | 反应后密闭容器中a的质量为22 g | |
| D. | 该反应中a、b、c、d四种物质(参加反应或生成)的质量比为22:9:111:80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com