
| 作物 | 小麦 | 玉米 | 茶树 | 西瓜 | 萝卜 |
| 适宜生长的pH | 5.5-6.5 | 6.5-7.0 | 4.0-6.5 | 5.0-7.0 | 7.0-7.5 |
分析 (1)含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥.同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥,据此分析.
(2)根据土壤酸碱度的pH为4.5,和表格中的作物最适宜的pH范围做出判断.
(3)根据物质间反应时是否放热判断;
(4)根据“可用于冷敷”说明水和该物质混合吸收热量.有的物质溶于水时会放出热量,使溶液温度升高,如浓硫酸、氢氧化钠等;也有些物质溶于水时会吸收热量,使溶液温度降低,如硝酸铵解答.
(5)根据铜具有良好的延展性和导电性分析;
(6)根据氧化铝的写法考虑;
(7)根据合金比组成成分金属的硬度大考虑.
(8)根据活性炭具有吸附性分析回答;
(9)根据区别软水和硬水的方法分析回答;
(10)根据灭火的原理分析回答.
解答 解:(1)碳酸钾(K2CO3)中含有钾元素,属于钾肥.
(2)土壤酸碱度的pH为4.5,茶树适宜生长的pH范围是4.0~6.5,所以适于种植茶树;适于玉米生长的pH范围是6.5~7.0,若要种植玉米就要降低土壤的酸性,可施用熟石灰降低土壤的酸性.
(3)生石灰与水反应放出大量的热,利用其放出的热量可对食物进行加热;反应的化学方程式为:CaO+H2O═Ca(OH)2;
(4)A、NaHCO3 溶于水时,溶液温度变化不大,故错.
B、硝酸铵晶体溶于水时吸收热量;故对.
C、氢氧化钠溶水时放出热量;故错.
(5)铜能制作导线,这是利用了金属铜的延展性和导电性;
(6)铝显+3价,氧显-2价,所以氧化铝的化学式是Al2O3;
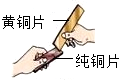
(7)合金比组成成分金属的硬度大,所以黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如右图所示),纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的大.
(8)由于活性炭具有吸附性,自然界中的水需净化后饮用,活性炭常用于净化水,其主要作用是吸附.
(9)啤酒酿造需要大量的软水,生活中常用肥皂水区别软水和硬水,遇肥皂水产生的泡沫少的是硬水,遇肥皂水产生的泡沫多的是软水.
(10)水常用于灭火,其灭火原理是隔绝氧气并降温至着火点以下.
故答案为:(1)钾.
(2)茶树;熟石灰.
(3)CaO+H2O═Ca(OH)2.
(4)B.
(5)导电性,.
(6)Al2O3.
(7)黄铜的硬度比纯铜的大.
(8)吸附;
(9)肥皂水;
(10)隔绝氧气并降温至着火点以下.
点评 本题考查的知识点较多,但难度不大,细心解答即可.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | A | B | C | D |
| 反应前质量g | 2 | 24.5 | 2 | 1 |
| 反应后质量g | 16.9 | 0 | 2 | 未知 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作步骤 | 实验现象 | 结论 |
| 用坩埚钳夹持一片维生素C药片放在酒精灯上灼烧 | 药片变黑 | 维生素C药片中含有碳元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂所用试剂和方法 |
| A | MnO2固体 | KCl固体 | 加水溶解、过滤、蒸发结晶 |
| B | NaOH溶液 | Ca(OH)2溶液 | 先加入过量的Na2CO3溶液,再过滤 |
| C | NaCl溶液 | Na2CO3溶液 | 加入澄清石灰水,过滤 |
| D | CaCl2固体 | CaCO3固体 | 加入过量的稀盐酸,蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验事实 | 数据分析及结论 |
| 2.12g石蜡完全燃烧,得到6.6g CO2和2.88g H2O | 写出计算过程: 结论:石蜡中不含氧元素. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com