

| 实验事实 | 数据分析及结论 |
| 2.12g石蜡完全燃烧,得到6.6g CO2和2.88g H2O | 写出计算过程: 结论:石蜡中不含氧元素. |
分析 (1)根据装置气密性的检查方法分析;首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(2)根据浓硫酸的作用和还原剂还原氧化铜分析;
(3)氢氧化钠可以与二氧化碳反应生成碳酸钠和水;
(4)根据质量守恒定律分析;
(5)根据题意“2.12g某物质在氧气中完全燃烧,生成6.6g二氧化碳和2.88g水”及质量守恒定律反应前后元素的质量及种类不变可知,该物质一定含有碳、氢元素,可能含有氧元素.再根据二氧化碳的碳元素、水中氢元素的质量的和与2.12g的关系,判定氧元素的存在情况;
(6)
解答 解:(1)该装置的气密性检查的方法是先关闭分液漏斗的活塞,将导气管一端放入水中,用手紧握烧瓶,若导管口有气泡产生,则装置气密性良好,反之,则不好;过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)浓硫酸浓硫酸具有水性,可以干燥氧气;氧化铜可以将一氧化碳转化为二氧化碳.
(3)氢氧化钠能与生成的二氧化碳反应生成碳酸钠和水,方程式为:2NaOH+CO2═Na2CO3+H2O.
(4)要测定石蜡中含有的元素要测定,要探究E中吸收水中的氢元素与F中吸收二氧化碳中碳元素的质量,和C中蜡烛质量的减少进行比较.
(5)由质量守恒定律反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.6.6g二氧化碳中碳元素的质量为:6.6g×$\frac{12}{44}$×100%=1.8g,2.88g水中氢元素的质量为:2.88g×$\frac{2}{18}$×100%=0.32g.1.8g+0.32g=2.12g与原物质的质量相等,故一定不含氧元素.
(6)装置内残留的空气含有水和二氧化碳或棉线烛芯燃烧也会产生水和二氧化碳或未完全燃烧的石蜡蒸气、碳黑残留在导管内或未进行多次重复实验等都会在成误差.
(7)针对你提出的误差原因,改进措施:实验前先通氧气将装置内的空气赶尽或取相同规格的棉线烛芯代替蜡烛,做相同的实验,然后扣除相应的数据或进行多次重复实验取平均值等.
故答案为:(1)先关闭分液漏斗的活塞,将导气管一端放入水中,用手紧握烧瓶,若导管口有气泡产生,则装置气密性良好,反之,则不好;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)干燥氧气;确保不完全燃烧的一氧化碳及碳全部转化为二氧化碳;
(3)2NaOH+CO2═Na2CO3+H2O.
(4)CEF;
(5)石蜡中不含氧元素;
(6)装置内残留的空气含有水和二氧化碳或棉线烛芯燃烧也会产生水和二氧化碳或未完全燃烧的石蜡蒸气、碳黑残留在导管内或未进行多次重复实验等;
(7)实验前先通氧气将装置内的空气赶尽或取相同规格的棉线烛芯代替蜡烛,做相同的实验,然后扣除相应的数据或进行多次重复实验取平均值等.
点评 本题难度较大,掌握蜡烛燃烧的实验、常见气体的检验方法、质量守恒定律(反应前后元素种类不变)是正确解答本题的关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:初中化学 来源: 题型:解答题
 如图为某医用葡萄糖注射液商标的一部分,请回答:
如图为某医用葡萄糖注射液商标的一部分,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 作物 | 小麦 | 玉米 | 茶树 | 西瓜 | 萝卜 |
| 适宜生长的pH | 5.5-6.5 | 6.5-7.0 | 4.0-6.5 | 5.0-7.0 | 7.0-7.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
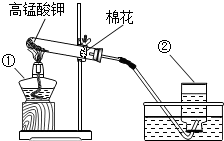 老师在课堂上用高锰酸钾利用下图所示的装置制取氧气.回答下列问题:
老师在课堂上用高锰酸钾利用下图所示的装置制取氧气.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
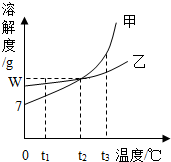 甲、乙两物质的溶解度曲线如图所示,下列叙述错误的是( )
甲、乙两物质的溶解度曲线如图所示,下列叙述错误的是( )| A. | t1℃时,甲的溶解度小于乙的溶解度 | |
| B. | t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和溶液 | |
| C. | 将甲、乙饱和溶液的温度从t3℃降到t1℃时,乙析出晶体比甲多 | |
| D. | t2℃时,甲或乙两种物质的饱和溶液中溶质与溶剂的质量比是W:100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com