
【题目】如图所表示的实验方法或操作正确的是( )
A.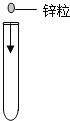 加锌粒B.
加锌粒B.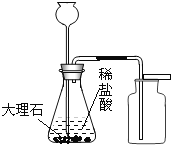 实验室制取二氧化碳
实验室制取二氧化碳
C.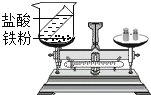 验证质量守恒定律D.
验证质量守恒定律D.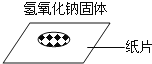 称量固体
称量固体
科目:初中化学 来源: 题型:
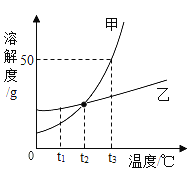
【题目】如图是甲、乙两种固体物质的溶解度曲线。能使乙的不饱和溶液变成饱和溶液的一种方法是______;t1℃时,相同质量的甲、乙分别配成饱和溶液,需加水的质量为甲___乙(填“ <”“>”“=”);t3℃时,将质量为x的甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%,则x=___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。
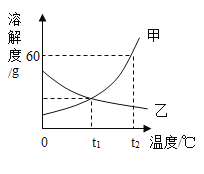
(1)在温度为_____℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,通过升温的方法能将接近饱和的溶液变为饱和溶液的是_____;
(3)t2℃时,将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数为_____;
(4)用一定的方法将乙的不饱和溶液变为饱和溶液,下列说法正确的是_____。
A溶剂的质量可能不变 B溶质质量分数一定变大
C溶液的质量一定不变 D溶质的质量一定变大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是一种可以在不同光照时变色的太阳镜,具有保护眼睛的功能。

(1)请将下列短文中带点的部分,用恰当的化学用语填写在横线上:该变色太阳镜中含有的金属单质__,铜制镜框使用时间过长会生成铜绿[Cu2(OH)2CO3],铜绿中铜元素的化合价为+2价__。
(2)结合镜片材料从天然水晶、光学玻璃到光学树脂的变迁过程,请你谈一谈化学与生活的关系:__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行研究,以下是他们探究的主要过程:
(假设)H2O2生成O2的快慢与催化剂种类有关
(实验方案)常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间.
(进行实验)如图是他们进行实验的装置图,气体发生装置中A仪器名称是:_____,此实验中B处宜采用的气体收集方法是:_____.

(实验记录)
实验编号 | 1 | 2 |
反应物 | 6% H2O2 | 6% H2O2 |
催化剂 | 1g红砖粉 | 1g MnO2 |
时间 | 152s | 35s |
(结论)该探究过程得出的结论是_____.
(反思)H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2或红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____和_____是否改变.
H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究.(只要求提出假设和实验方案)
(假设)_____.
(实验方案)_____.
你若还能提出新的合理的假设和实验方案。
(假设)_____.
(实验方案)_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作,请回答:
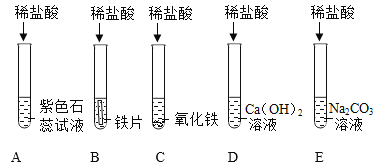
(1)写出C中反应的化学方程式___________________。
(2)装置B中的反应现象:首先观察到__________________,随后观察到___________________,发生反应的化学方程式是___________________。
(3)将反应后D.E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出向题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaC1和CaCl2
猜想三:NaC1、CaCl2和Na2CO3
猜想四:______________(填化学式)
(进行讨论)经过讨论,同学们一致认为猜想____________________是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 | ________________ | 猜想四成立 |
(4)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。计算这些石油产品中含硫酸的质量是多少?___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我校化学兴趣小组同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究。
(知识回放)通过判断上述四种溶液两两之间能否发生反应,我能写出其中一个中和反应的化学方程式:________________。
(挖掘实质)
(1)图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl和NaOH在水中会解离出相应离子,以此类推硝酸钡在水中会解离出Ba2+和_______________(填离子符号)。
(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为___,我也能用同样的方式表示上述四种溶液两两之间发生反应时且有气体生成的反应的实质是![]() 。
。
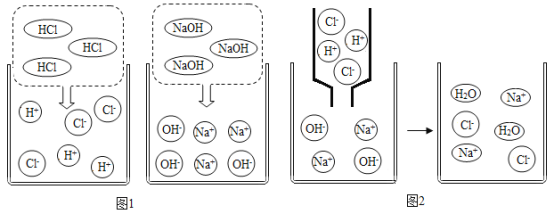
(3)通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和H2SO4溶液能发生复分解反应.因为溶液中的H+和OH-不能大量共存;H2SO4溶液和Ba(NO3)2溶液也可以发生复分解反应,因为Ba2+和SO42-在溶液中____________(填“能”或“不能”)大量共存;NaOH和K2CO3溶液不能发生复分解反应,因为_____和Na+和OH-能大量共存。
(知识升华)通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是离子交换,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】没有空气就没有生命,没有前辈科学家的不断追求就没有今天的科技发展。
(1)下图是在我们教材上册P13的“空气中氧气体积分数的测定”实验装置示意图。
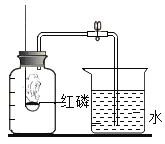
①红磷在空气中燃烧的化学方程式为______________。
②实验完毕后,集气瓶内水面上升到一定高度后,不再继续上升。这种现象说明氮气具有的性质是____________;若从烧杯中进入集气瓶内水的体积明显小于预期,结合图示分析导致误差产生的一条可能主观原因是_____________。
③因实验是在集气瓶外点燃红磷,造成的不良后果是______________。
(查阅资料)红磷的着火点为240℃;白磷40℃时即可燃烧,且与红磷燃烧的产物相同。
④实验小组用手持仪器测定白磷在空气中燃烧时氧气体积分数变化曲线如下图示。
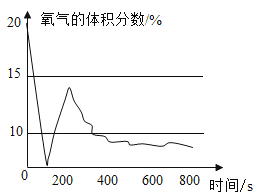
结合上述问题分析和对图像观察,谈谈你对可燃物燃烧的重新认识:_________________。
⑤下图是法国化学家拉瓦锡曾用定量方法研究空气成分的实验装置示意图。通过实验,拉瓦锡得出空气是由氧气和氮气组成,其氧气约占空气总体积1/5的结论。根据现在的认识,请对此加以补充:_______________。
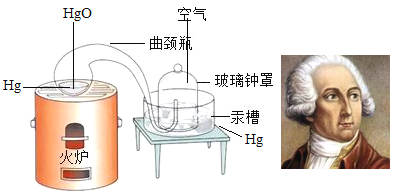
(2)在1777年,拉瓦锡利用⑤的图示装置还研究了氧化汞的分解与生成物中各物质之间的关系,得出结论:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。
⑥质量守恒的原因在于化学反应前后________
A物质的种类没有改变 B分子的种类没有改变
C分子的数目没有改变 D原子的种类、数目和质量都没有改变
⑦下列日常生活中的现象,遵守质量守恒定律的是________。
A衣服淋湿后变重了 B蜡烛燃烧后质量减少了
C白醋放在敞口容器中 D用洗洁精洗去盘子的油污
⑧在化学反应A+2B=C+D中,5.6gA和7.3g的B恰好完全反应,生成了12.7gC,同时得到D物质的质量是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com