
分析 甲溶液呈碱性,说明甲中含有OH-,那么甲中的其他三种离子就都可以与氢氧根离子共存,那么会有氯离子、钾离子、碳酸根离子.其余的都为乙溶液中的离子.
解答 解:甲溶液呈碱性,所以甲溶液中一定有OH-,那么Ag+一定在乙溶液中(会和OH-结合经过一系列变化而产生沉淀),所以乙溶液中不可能有Cl-(会和Ag+产生沉淀),所以Cl-在甲溶液中.由于甲溶液中有OH-,所以H+在乙溶液中,因此乙溶液中不可能有CO32-,CO32- 在甲溶液中.甲溶液中已经有三种阴离子了,剩下的一种肯定是阳离子.阳离子不可能是H+或
Ba2+(都会和CO32-反应),只能是K+离子.这样甲溶液中的四种离子就出来的.剩下的四种就在乙溶液中.
综上所述:
甲溶液里有:OH-、Cl-、CO32-、K+
乙溶液里有:Ag+、H+、Ba2+、NO3-
故答案为:OH-、Cl-、CO32-、K+;H+、Ag+、Ba2+、NO3-.
点评 此题是离子共存问题的考查,解题的关键是只要离子结合不会形成沉淀、水、气体时则离子就能共存.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
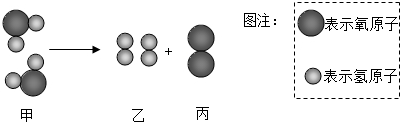
| A. | 反应前后分子的数目发生改变 | |
| B. | 反应前后分子的种类发生改变 | |
| C. | 分子是化学变化中的最小微粒 | |
| D. | 甲、乙、丙三种分子的个数比为2:2:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
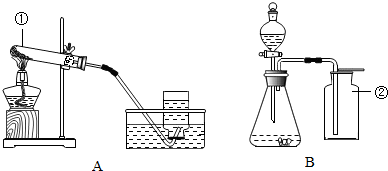
| 实验步骤 | 实验现象 |
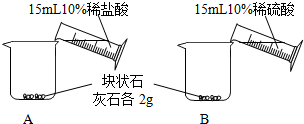 | A中不断产生气泡,固体逐渐减少,有少量固体剩余. B中开始有少量气泡产生,反应很快停止. |
| 实验步骤 | 实验现象 |
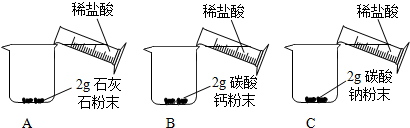 | A中迅速产生大量气泡,固体很快减少,有少量固体剩余. B、C中都迅速产生大量气泡,固体很快消失. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
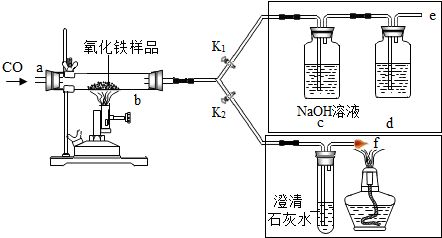
| 编号 | 称量物 | 反应前 | 反应后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫化羰可用来灭火 | |
| B. | 硫化羰是氧化物 | |
| C. | 相同分子数的硫化羰与二氧化碳比较,硫化羰质量小 | |
| D. | 如果硫化羰中碳元素的化合价为+4,则硫元素的化合价为-2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | |
| 溶解度 /g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
| Ca(OH)2 | 0.19 | 0.18 | 0.16 | 0.15 | 0.14 | 0.13 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com