
【题目】在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
科目:初中化学 来源: 题型:
【题目】将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应中质量/g | 2.6 | 6.4 | 2.2 | 0.9 | m |
反应后质量/g | a | b | c | 2.7 | n |
下列判断正确的是( )
A.表中m=1.4,n=3.2B.该反应属于置换反应
C.物质X中一定没有碳元素D.物质X中一定没有氢元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产生活中应用广泛。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是____。
(2)铁生锈的条件是_____。
(3)下列铜制品的用途中,利用金属导电性的是____(填字母).
A.  铜火锅
铜火锅
B. 铜导线
铜导线
C.  铜钟
铜钟
D.  铜钱
铜钱
(4)金属的回收和利用是保护金属资源的一种有效途径。
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为_____。
②将铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后,对剩余固体成分的判断正确的是_____
A 肯定有银
B 肯定有铜
C 可能有铁
D 可能是铁和银
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案设计正确的是
选项 | 实验目的 | 实验方案 |
A | 20℃时,配制硝酸钾饱和溶液100g(已知:20℃时,硝酸钾的溶解度为31.6g) | 20℃时,将31.6g的硝酸钾固体溶于68.4mL水中 |
B | 检验久置空气中的氢氧化钠固体是否变质 | 取样加水溶解后滴加酚酞试液,观察溶液是否变红 |
C | 除去铁钉表面的铁锈 | 取样加过量的稀硫酸,长时间浸泡 |
D | 鉴别化肥KNO3和NH4C1 | 取样与熟石灰混合研磨,闻气味 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】恒温蒸发某物质的溶液,现象如图所示,说法正确的是
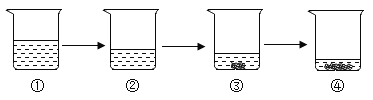
A.①②都是不饱和溶液
B.溶质质量分数的大小:①<②<③<④
C.溶质的质量:①=②>③>④
D.该物质的溶解度随温度升高而变大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,氰化钠由钠、碳和氮元素组成,这三种元素的化合价分别是+1、+2、﹣3,氰化钠的化学式为
A.NaCN
B.NaC2N2
C.Na2CN
D.NaCN2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】智能手机屏幕解锁图形如图所示,若数字 1、3、4、6、7、8、9 分别是 铁、硫酸铜、氧气、氢氧化钠、二氧化碳、木炭粉、一氧化碳中的一种,其中数字3 代表的物质 是一种年产量最高的金属(“—”表示相连的物质间能发生化学反应)。请回答下列问题:
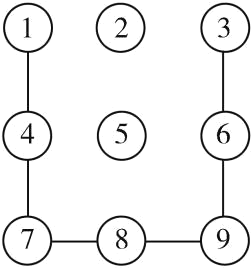
(1)写出数字1 和数字 4 反应的化学方程式 ______________________。
(2)上述所有反应都没有涉及的基本反应类型是 ______________________。
(3)甲同学认为这样的解锁图案太简单了,还没有把 3-2-5 连接 起来,于是他在原物质的基础上选择了两种新物质放在数字 2 和 数字 5 的位置上,其中数字 2 代表物质和其他原物质类别不同, 则数字 2 和数字 5 分别是代表物质可以是__________和__________(各写一种合理的物质)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2016年3月22日是第二十四届“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:
(1)保持水的化学性质的最小粒子是___ (填名称)。
(2)将下列物质分别加入水中,不能形成溶液的是___ (填序号) 。
A 冰块
B 纯碱
C 面粉
D 酒精
(3)我国水资源丰富,但分布不均。天津属于极度缺水城市,周边区县有些村民用地下水作为生活用水,人们常用________________检验地下水是硬水还是软水;生活中可用_____________的方法降低水的硬度。
(4)自然界中的水一般要净化后才能使用。综合运用①过滤②沉淀③蒸馏几项操作净水效果更好,其先后顺序是____ (填序号)。
(5)高铁酸钾(K2FeO4) 是一种新型、高效的多功能水处理剂。高铁酸钾受热时发生的反应为![]() , 则R是_______________ (填化学式)。
, 则R是_______________ (填化学式)。
(6)某品牌的碳酸饮料中含有水、柠檬酸、二氧化碳、蔗糖等成分。开启瓶盖时,有大量气泡冒出, 说明随着压强的减小,气体溶解度_______________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
生活中我们谈到“细菌”往往会心惊胆战。其实细菌不仅仅只有危险的一面,如果掌握了它们的特性,很多细菌也可以为我们服务。氧化亚铁硫杆菌(以下简称为T·f菌,见图左)是一种细菌,它被广泛应用于治理废气、废渣等有害物质。例如用T· f菌脱除工业废气中的一种有毒、有腐蚀性的气体——硫化氢(H2S)。其作用原理如图所示。


这个净化过程中,Fe2(SO4)3溶液在常温常压下就可以将废气中的H2S脱出,生成FeSO4 。FeSO4在酸性溶液中、在T· f菌的帮助之下,只需少量的氧气就又可以转化为Fe2(SO4)3 ,同时释放的能量还能供给T· f菌生长。用这种方法处理废气大大降低了治污的成本,脱除率达到99.97%,且无废物排出。但要达到高效的关键是要保证体系内FeSO4 浓度的稳定,一旦FeSO4 浓度降低,T· f菌就会像缺少食物一样逐渐失去活性。实际应用过程发现Fe2(SO4)3在pH=l.9时会发生一定的变化,生成了铁的沉淀物——黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕,并在pH=3.2时沉淀完全,使得溶液中的总铁浓度下降。可见溶液的pH值对这个方法的效果有一定影响。实验测得30℃时,不同pH环境下T· f菌的活性不同,表现为FeSO4溶液转化为Fe2(SO4)3溶液的速率不同,如下表:
pH | 0.9 | 1.2 | 1.5 | 1.9 | 2.1 | 2.4 | 2.7 | 3.0 |
FeSO4溶液转化为Fe2(SO4)3速率/(gL﹣1h﹣1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
回答下列问题:
(1)在环节①中化合价升高的元素是_____(填写元素符号)。
(2)环节②的反应原理为:4 F e S O4+ O2+ 2X![]() 2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
(3)黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕中铁元素与硫元素的原子个数比为__________。
(4)用T·f菌脱除废气中的H2S气体的优点是_______(写出1点即可)
(5)请结合文中信息,判断工业用T·f菌脱硫应选择的最佳pH范围是_____<pH<__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com