
【题目】阅读下面科普短文。
生活中我们谈到“细菌”往往会心惊胆战。其实细菌不仅仅只有危险的一面,如果掌握了它们的特性,很多细菌也可以为我们服务。氧化亚铁硫杆菌(以下简称为T·f菌,见图左)是一种细菌,它被广泛应用于治理废气、废渣等有害物质。例如用T· f菌脱除工业废气中的一种有毒、有腐蚀性的气体——硫化氢(H2S)。其作用原理如图所示。


这个净化过程中,Fe2(SO4)3溶液在常温常压下就可以将废气中的H2S脱出,生成FeSO4 。FeSO4在酸性溶液中、在T· f菌的帮助之下,只需少量的氧气就又可以转化为Fe2(SO4)3 ,同时释放的能量还能供给T· f菌生长。用这种方法处理废气大大降低了治污的成本,脱除率达到99.97%,且无废物排出。但要达到高效的关键是要保证体系内FeSO4 浓度的稳定,一旦FeSO4 浓度降低,T· f菌就会像缺少食物一样逐渐失去活性。实际应用过程发现Fe2(SO4)3在pH=l.9时会发生一定的变化,生成了铁的沉淀物——黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕,并在pH=3.2时沉淀完全,使得溶液中的总铁浓度下降。可见溶液的pH值对这个方法的效果有一定影响。实验测得30℃时,不同pH环境下T· f菌的活性不同,表现为FeSO4溶液转化为Fe2(SO4)3溶液的速率不同,如下表:
pH | 0.9 | 1.2 | 1.5 | 1.9 | 2.1 | 2.4 | 2.7 | 3.0 |
FeSO4溶液转化为Fe2(SO4)3速率/(gL﹣1h﹣1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
回答下列问题:
(1)在环节①中化合价升高的元素是_____(填写元素符号)。
(2)环节②的反应原理为:4 F e S O4+ O2+ 2X![]() 2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
2F e2(S O4)3+2H2O其中物质“X”的化学式为_____。
(3)黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕中铁元素与硫元素的原子个数比为__________。
(4)用T·f菌脱除废气中的H2S气体的优点是_______(写出1点即可)
(5)请结合文中信息,判断工业用T·f菌脱硫应选择的最佳pH范围是_____<pH<__。
【答案】S H2SO4 3 : 2 成本低,脱除率达到99.97%,且无废物排出 1.5 1.9
【解析】
(1)由图可知,环节①是硫酸铁和硫化氢反应生成硫和硫酸亚铁,硫酸铁中铁元素为+3价,硫酸亚铁中铁元素为+2价,化合价降低,硫化氢中氢元素通常为+1价,设硫化氢中硫元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(+1)×2+x=0,x=-2,硫单质中硫元素化合价为0,故硫元素的化合价升高,故填:S;
(2)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含4个铁原子、4个硫原子、18个氧原子,生成物中含4个铁原子、6个硫原子,4个氢原子、26个氧原子,故反应物中还应含有2个硫原子、4个氢原子,8个氧原子,故X的化学式为:H2SO4;
(3)由黄铵铁矾的化学式NH4Fe3(SO4)2(OH)6可知,黄铵铁矾中铁元素与硫元素的原子个数比为:3:2;
(4)由资料可知,用T·f菌脱除废气中的H2S气体的优点是:降低了治污的成本,脱除率达到99.97%,且无废物排出;
(5)由资料可知,Fe2(SO4)3在pH=l.9时会发生一定的变化,生成了铁的沉淀物——黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕,并在pH=3.2时沉淀完全,使溶液中的总铁浓度下降,pH<1.5时,FeSO4溶液转化为Fe2(SO4)3速率减慢,说明T·f菌活性减小,反应速率减慢,故工业用T·f菌脱硫应选择的最佳pH范围是1.5<pH<1.9。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:
【题目】在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室部分仪器和装置如图所示
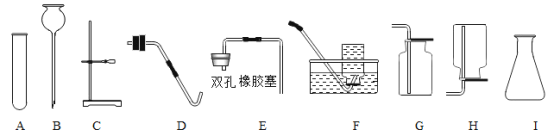
(1)实验室用高锰酸钾制取和收集氧气需要补充的玻璃仪器和用品是_____;发生反应的化学方程式是:_____。
(2)组装一套用过氧化氢溶液制取较多量氧气的反应装置,应该选图中的_________(填字母);选择该装置的依据是_________。
(3)收集二氧化碳应该选用装置G,不选用其他收集装置的原因是_________;对收集到的二氧化碳进行验满的操作是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:

(1)操作①中被磁铁吸引的金属A是________________;
(2)操作a的名称是________________;
(3)写出步骤②所涉及的化学反应方程式:___________________________;
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂_________(填标号)。
a 硫酸铜溶液 b 氯化钠溶液 c 硝酸银溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题:
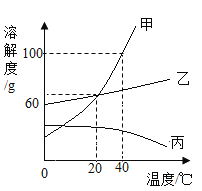
(1)20°C时,饱和溶液的溶质质量分数相等的物质是_________________。
(2)不改变溶液的成分,将丙的不饱和溶液变为饱和溶液的方法是_________________。
(3)20 °C时,把60 g甲物质加入50 g水中,得到溶液的质量为_________________g,若要得到溶质质量分数为50%的甲溶液,继续进行的具体操作是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)如图,该装置可用于实验室制取氧气。

①如图制取O2的反应的化学方程式为______。
②氧气可用排水法,还可以用__________方法收集
(2)如图该装置可用于实验室制取二氧化碳并探究二氧化碳的性质

①制取CO2反应的化学方程式为___________。
②将二氧化碳通入紫色石蕊试剂中,观察到的现象是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)防控“新冠”疫情,怎样消毒才最有效?为了探究此问题,同学们对此次防控“新冠”疫情所使用的消毒剂进行了调查。
①某消毒剂是紫黑色固体,俗名为灰锰氧,属于钾盐,请写出其化学式,并标出其除钾外的金属元素的化合价_____。
②某物质R是一种环境消毒剂,可杀死空气中的新型冠状病毒,但如果遇到H2S气体就会失效,其反应方程式为6R+5H2S=6HCl+5SO2+2H2O,则R的化学式为_____。
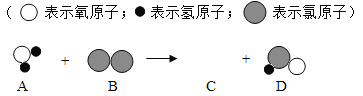
③“84”消毒液是一种以次氯酸钠为主的高效消毒剂,次氯酸钠与空气中的某些物质反应生成次氯酸,“84”消毒液就是用此原理进行消毒。自来水消毒过程中也是利用次氯酸进行消毒,已知自来水消毒过程中所发生的化学反应的微观过程可用下图表示,C物质的化学式为_____。
④同学们在实验室配制过氧化氢溶液来对照市面上购买的双氧水消毒液。若加入的过氧化氢和水的质量比为1:18,则该溶液中氢、氧元素的原子个数比是_____。
(2)①将盛有等质量、等质量分数稀盐酸的两只烧杯,分别放在托盘天平的左右两盘,此时天平平衡,向一只烧杯中加入一定质量的镁粉,另一只烧杯中加入一定质量的铁粉,充分反应后,天平仍然平衡。则加入镁和铁的质量比不可能为_____(填序号)。
a、11:12
b、1:1
c、81:77
②某同学要探究铜、X、锌三种金属的活动性顺序,设计了如图所示的实验方案,若试管甲中无现象,则试管_____的实验是多余的。去掉多余的实验,同学们将另两支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物,取不溶物
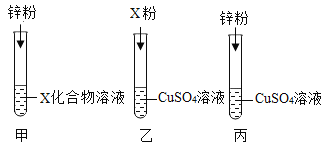
于试管丁中,加入过量稀硫酸,发现有气泡产生,则试管丁中溶液一定含有的溶质是_____(填化学式)。
(3)实验小组在室温(20℃)下进行粗盐(含泥沙的氯化钠)提纯,向5g粗盐中加入15mL水,充分溶解过滤后得到溶液A,其蒸发过程中溶液质量与时间变化关系如图所示,相关分析正确的是_____。(已知20℃氯化钠的溶解度为36g)
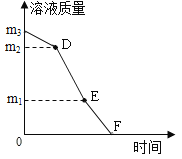
a、m1<20g
b、(m2一m3)是减少的水的质量
c、D、E点表示的溶液溶质质量分数相同
d、F点时,停止加热
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CO混有少量的CO2,用右图装置收集瓶较纯净的CO,说法错误的是
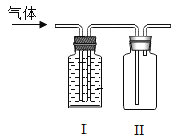
A.I中溶液是氢氧化钠溶液
B.气体通入后,I中的液体会流向II
C.反应结束后,CO收集在II中
D.若I中导气管始终保持液封,则不必尾气处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com