
【题目】粗盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。同学们为了得到更纯的NaCl,设计了如下实验方案:
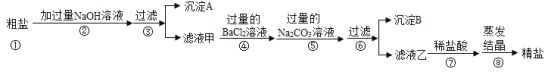
请回答下列问题:
(1)沉淀A的化学式是______;
(2)若将步骤④和⑤顺序颠倒会引发的后果是______;
(3)沉淀B中除了含有CaCO3以外还含有______(填化学式);
(4)滤液乙中含有的阴离子是______(填离子符号)。
【答案】Mg(OH)2 精盐中会混有氯化钡 BaSO4 、BaCO3 Cl-、OH-、CO32-
【解析】
(1)盐与碱之间的反应是复分解反应,生成物中必须有沉淀,加入过量NaOH 溶液,NaOH 溶液只能与粗盐中的MgCl2反应,MgCl2 +2NaOH==Mg(OH)2↓+2NaCl,所以沉淀A的化学式是Mg(OH)2。
(2)加入氯化钡,除去SO42-,反应的化学方程式为:Na2SO4+BaCl2==BaSO4↓+2NaCl,加入碳酸钠除去Ca2+和前面过量的Ba2+,反应的化学方程式为:Na2CO3+CaCl2==CaCO3↓+2NaCl、BaCl2 +Na2CO3 ==BaCO3↓+2NaCl。加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去,精盐中会混有氯化钡;
(3)根据除杂过程可知,沉淀B中含有CaCO3、BaSO4、BaCO3,故填:BaSO4、BaCO3;
(4)根据除杂过程可知,滤液乙中含有的溶质是NaCl、Na2CO3、NaOH,所以含有的阴离子是Cl-、OH-、CO32-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】![]() 是初中常见的8种物质,它们有如图所示的转化关系、已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。
是初中常见的8种物质,它们有如图所示的转化关系、已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。
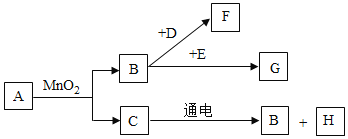
![]() 请写出下列物质的化学式:D______,E______,G______,H______。
请写出下列物质的化学式:D______,E______,G______,H______。
![]() 请写出下列变化的化学方程式:
请写出下列变化的化学方程式:![]() ______。
______。
![]() 物质F在生活中的用途:______。
物质F在生活中的用途:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用,我国化学家侯德榜创立了著名的“侯氏制碱法”,促进了世界技术的发展。
(查阅资料)①生产原料粗盐中含有少量可溶性杂质(MgCl2 和 CaC12)及不溶性杂质。
②氨气极易溶于水,二氧化碳能溶于水。
③生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1,分离得晶体 A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是 NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:
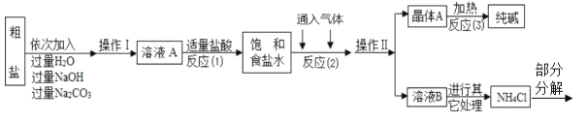
(问 题讨论)
(1)溶液 A 中的溶质为 ________,流程中加入适量盐酸的作用是 ________。
(2)反应(2)中为提高产率,所通入气体的顺序是 ________(填字母序号).
A.先通入 CO2 再通入 NH3 B.先通入 NH3 再通入 CO2
(3)上述生产流程中可循环使用的是 ________(填序号).
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(组成确定)
(1)称取一定质量的纯碱样品,多次充分加热,称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀 HNO3,再滴加 AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ________(写化学式).
(含量测定) 同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下三组实验。甲组:取 12.0g 纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。将反应所得溶液小心蒸发,并将所得物质干燥、冷却至室温称得固体质量为 13.1g.样品中碳酸钠的质量分数为________。
乙组:取 12.0g 纯碱样品,利用下图所示装置,测出反应装置 C 增重了 4.1g(所加试剂均足量,每一步都反应完全).实验结束,发现乙组测定的质量分数偏小,其原因是_________。
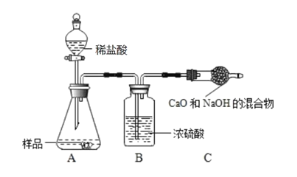
丙组:取 12.0g 的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀过滤、 洗涤、烘干称量固体质量,从而计算出碳酸钠的质量分数。组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 ________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据以下实验内容,回答相关问题。
[实验目的]证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
[实验原理]____________(用化学方程式表示);
[药品仪器]
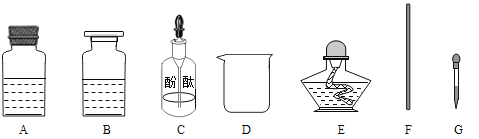
[实验步骤]
①取_______(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用_______(填图中仪器对应字母)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色:
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生。
[思考拓展](1)步骤③的目的是____________;
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是_____________;
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH | <8.2 | 8.2~10.0 | >10.0 |
颜色 | 无色 | 红色 | 无色 |
某同学发现:向某氢氧化钠溶液中滴加酚酞试液后溶液显无色;逐滴加稀盐酸,溶液先变红,后褪至无色。你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是_________;请设计实验证明你的精想(写出简要的操作步骤与现象)_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)请用你学到的化学知识回答下列问题:
①如果图书馆里的图书或档案资料着火了,如何灭火?______________________
②可燃冰外观像冰,主要含有甲烷水合物,在海底有大量的储藏量。如果在开采可燃冰时,甲烷气体大量泄漏,造成的后果是什么?______________________
③氢气为什么被称为理想的燃料?_____________ ;
④为什么在加油站、面粉加工厂等地方有“严禁烟火”等字样或图标?______________________
(2)分析下列图像,按要求回答下列问题:
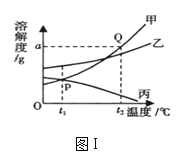
①图Ⅰ中t1℃ 时,_____________的溶解度最大;将丙的饱和溶液变为不饱和溶液,可将溶液的温度__________;将t2℃时等质量的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为_______________。
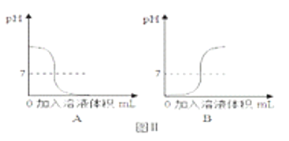
②图Ⅱ是中和反应过程中溶液pH值变化的图像,其中能表示向稀盐酸溶液中滴加氢氧 化钠溶液的是 _________ (填“A”或“B”),该中和反应的实质是___________ (要求用文字叙述)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是()
A. 用氢气还原10g氧化铜,加热片刻后,冷却称得剩余固体质量为8.4g,则参加反应的氧化铜的质量是8g
B. 将5g某物质完全溶解于95g水中,所得溶液中溶质的质量分数一定是5%
C. 将3g碳和6g氧气在密闭容器中点燃,充分反应后,容器中的气体为纯净物
D. 将一定量的氢氧化钠和氢氧化钙的混合物溶于足量水中,再向溶液中加入过量的碳酸钠溶液,充分反应后,生成的沉淀质量与原混合物的质量相等,则原混合物中氢氧化钠的质量分数为26%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列粒子结构示意图,回答问题。
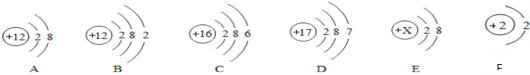
(1)上图A、B、C、D四种粒子共表示_____种元素;
(2)D原子在化学反应中易_____(填“得到”或“失去”)电子;
(3)上图从A至F中达到相对稳定结构的是_____;
(4)E粒子带1个单位负电荷,则X=_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的同学们为验证碳在氧气中不完全燃烧产生的混合气体中既有CO又有CO2,设计了如图所示的装置,请回答问题。
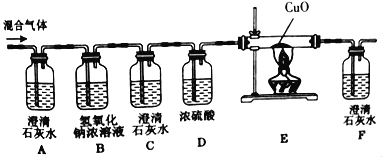
[查阅资料](1)氢氧化钠浓溶液能与二氧化碳反应,反应过程中无明显现象。
(2)浓硫酸常用作气体的干燥剂。
(1)B装置中NaOH浓溶液的作用是_____;
(2)实验开始时,必须先通入混合气体一段时间再点燃酒精灯加热,目的是_____;
(3)实验过程中,观察到_____现象时,可证明混合气体中既有CO又有CO2;
(4)写出E装置玻璃管中发生反应的化学方程式_____,其中发生还原反应的物质是_____;
(5)从环保角度分析,写出该装置设计中的一处明显不足_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com