
【题目】碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用,我国化学家侯德榜创立了著名的“侯氏制碱法”,促进了世界技术的发展。
(查阅资料)①生产原料粗盐中含有少量可溶性杂质(MgCl2 和 CaC12)及不溶性杂质。
②氨气极易溶于水,二氧化碳能溶于水。
③生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1,分离得晶体 A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是 NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:
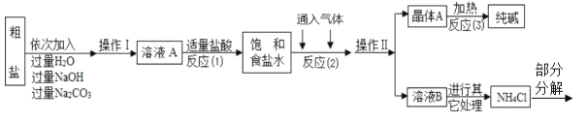
(问 题讨论)
(1)溶液 A 中的溶质为 ________,流程中加入适量盐酸的作用是 ________。
(2)反应(2)中为提高产率,所通入气体的顺序是 ________(填字母序号).
A.先通入 CO2 再通入 NH3 B.先通入 NH3 再通入 CO2
(3)上述生产流程中可循环使用的是 ________(填序号).
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(组成确定)
(1)称取一定质量的纯碱样品,多次充分加热,称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀 HNO3,再滴加 AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ________(写化学式).
(含量测定) 同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下三组实验。甲组:取 12.0g 纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。将反应所得溶液小心蒸发,并将所得物质干燥、冷却至室温称得固体质量为 13.1g.样品中碳酸钠的质量分数为________。
乙组:取 12.0g 纯碱样品,利用下图所示装置,测出反应装置 C 增重了 4.1g(所加试剂均足量,每一步都反应完全).实验结束,发现乙组测定的质量分数偏小,其原因是_________。
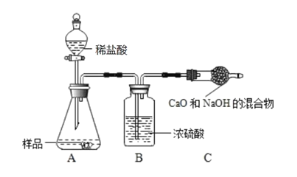
丙组:取 12.0g 的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀过滤、 洗涤、烘干称量固体质量,从而计算出碳酸钠的质量分数。组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 ________。
【答案】NaCl、NaOH、Na2CO3; 将氢氧化钠、碳酸钠转化成氯化钠; B; ABCE; NaCl; 88.3%; 生成的二氧化碳气体没有被C中的烧碱完全吸收。 同质量的碳酸钠生成碳酸钡的质量远大于碳酸钙,称量误差小。
【解析】
问题讨论:(1)粗盐中含有少量可溶性杂质(MgCl2和CaCl2),氯化镁能与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,所以A中的溶质主要是氯化钠,由于氢氧化钠和碳酸钠过量,溶液A中也有氢氧化钠和碳酸钠;
过量的氢氧化钠、碳酸钠对于氯化钠来说仍是杂质,氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以流程中加入适量盐酸的作用是:将氢氧化钠、碳酸钠转化成氯化钠;
(2)二氧化碳是酸性气体,在碱性溶液中的溶解度较大,所以先通入NH3再通入CO2,故选B;
(3)根据生产流程中涉及的方程式和流程图,发现二氧化碳、氨气、氯化氢、碳酸钠为重复使用的物质,故选ABCE;
组成确定:氯化银是不溶于稀硝酸的白色沉淀,加入硝酸银溶液生成白色沉淀,不溶于稀硝酸,沉淀是氯化银沉淀,说明原碳酸钠中含有氯化钠;
含量测定:甲组:设样品中碳酸钠的质量为x
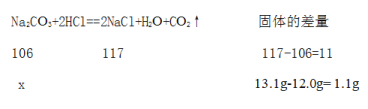
![]() =
=![]() ,解得x=10.6g
,解得x=10.6g
乙组:乙组测定的质量分数偏小,其直接原因是C装置增重少,可能原因是生成的二氧化碳气体没有被C中的烧碱完全吸收;
丙组:因为同质量的碳酸钠生成碳酸钡的质量远大于碳酸钙的质量,称量误差小于碳酸钙,计算出碳酸钠的质量分数误差也就越小。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组进行如下组合实验,对二氧化碳的性质进行验证。
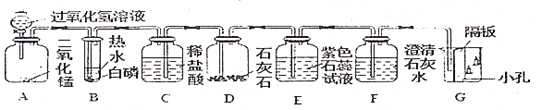
当打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进人D中。E处紫色石蕊溶液变成红色,F处澄清石灰水变浑浊。
(1)A中发生反应的化学方程式为________。
(2)B中白磷能够燃烧的原因是____________;_______________。
(3)G烧杯中___________(填“上层”或“下层”)的蜡烛先熄灭,说明二氧化碳具有的物理性质是___________,具有的化学性质是_____________。
(4)E处使紫色石蕊变成红色的物质是________________;
(5)写出D处发生变化的化学方程式_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将10%HCl溶液和未知浓度的NaOH溶液混合均匀并测量记录溶液温度,实验结果如有图所示,每次实验中HCl溶液和NaOH溶液的质量总和始终保持46.5g,根据相关信息回答下列问题:
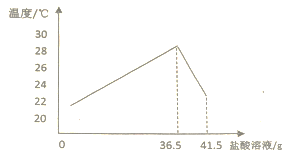
(1)该反应是_____(填“吸热”或“放热”)反应;
(2)恰好反应时盐酸溶液的质量为_____g;
(3)计算NaOH溶液的溶质质量分数_____。(写出计算过程)
(4)当滴加盐酸41.5g时,所得溶液中氯化钠的溶质质量分数为______。(保留小数点后两位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中A、B、C、D是四种拉子的结构示意图,E为氬元素在元素周期表中的信息示意图。
(1)B元素属于(填“金属”或“非金属”)_____元素;A元素的质子数为_____。
(2)图中A、B、C、D四种粒子表示原子的是_____,表示阳离子的是_____。
(3)图中A、B、C、D四种粒子表示稳定结构的是为_____。
(4)对E中提供的信息理解正确的是_____。
①属于金属元素②中子数为18③核电荷数为18④相对原子质量为40
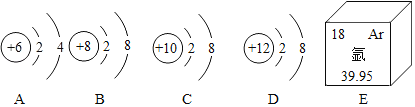
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是以空气和其他原料合成 NH4NO3 的工业流程,下列说法不正确的是 ( )
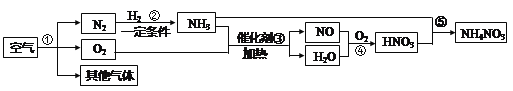
A. ①中所得“其他气体”中稀有气体含量最高
B. 上述流程中涉及到的化合反应有 3 个
C. ④中参加反应的 O2 和 H2O 的质量之比 16:9
D. 理论上,若③和⑤中 NH3 的量相同,则合成 NH4NO3 时氨气的利用率最高
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】纯净物A可用作燃料。在一定条件下,将一定质量的A与80g B按图所示充分反应,当B反应完全时,生成66g C和36g D
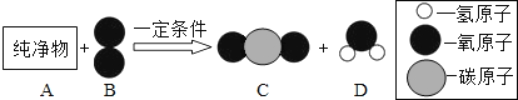
(1)一个D分子中共含有_____个原子。
(2)B、C、D三种物质中,属于氧化物的是_____。
(3)参加反应的A物质的质量是_____g,已知A的相对分子质量为44,则图示反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从宏观、微观和量的角度描述化学反应是化学特有的方式。下面是对稀盐酸与氢氧化钠反应的不同描述。图A是实际操作图,图B是微观粒子结合过程的图示,图C是反应过程中溶液的酸碱度变化曲线。根据要求回答下列问题:
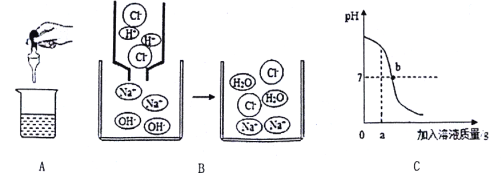
(1)该变化对应的实验操作是将_______滴加到另一种溶液中;
(2)当滴入溶液的质量为ag时,溶液中溶质为______(填化学式);
(3)b点溶液中主要的离子是_____(填离子符号);
(4)该反应的实质是______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】粗盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。同学们为了得到更纯的NaCl,设计了如下实验方案:
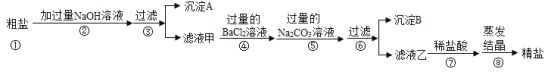
请回答下列问题:
(1)沉淀A的化学式是______;
(2)若将步骤④和⑤顺序颠倒会引发的后果是______;
(3)沉淀B中除了含有CaCO3以外还含有______(填化学式);
(4)滤液乙中含有的阴离子是______(填离子符号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“生命可贵,安全第一”。下列采取的安全措施中不正确的是![]()
![]()
A. 发现室内有天然气泄露,不能立即打开排气扇
B. 酒精洒在桌面应立即用湿抹布扑盖灭火
C. 家用电器着火,应立即用水浇灭
D. 进入久未开启的菜窖前,先做灯火实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com