
【题目】从宏观、微观和量的角度描述化学反应是化学特有的方式。下面是对稀盐酸与氢氧化钠反应的不同描述。图A是实际操作图,图B是微观粒子结合过程的图示,图C是反应过程中溶液的酸碱度变化曲线。根据要求回答下列问题:
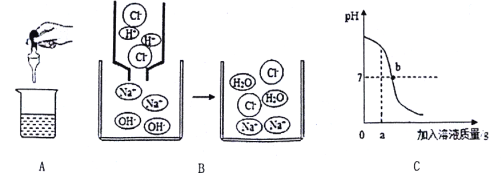
(1)该变化对应的实验操作是将_______滴加到另一种溶液中;
(2)当滴入溶液的质量为ag时,溶液中溶质为______(填化学式);
(3)b点溶液中主要的离子是_____(填离子符号);
(4)该反应的实质是______
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
【题目】溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母)。
A.高锰酸钾 B.汽油 C.面粉
(2)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60℃时,氯化钠的溶解度_______硝酸钾的济解度(填“>”“=”或“<”)。
②向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量____(填“增大”“不变”或“减小”)。
③混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离
(3)如图所示为X、Y、Z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
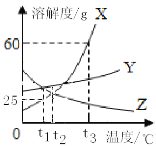
①t3℃时,溶质质量分数为25%的X溶液降温到t1℃,所得溶液中溶质质量分数是________。
②t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,溶液质量没有变化的是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用,我国化学家侯德榜创立了著名的“侯氏制碱法”,促进了世界技术的发展。
(查阅资料)①生产原料粗盐中含有少量可溶性杂质(MgCl2 和 CaC12)及不溶性杂质。
②氨气极易溶于水,二氧化碳能溶于水。
③生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1,分离得晶体 A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是 NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:
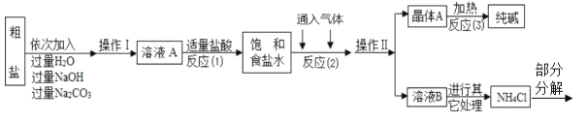
(问 题讨论)
(1)溶液 A 中的溶质为 ________,流程中加入适量盐酸的作用是 ________。
(2)反应(2)中为提高产率,所通入气体的顺序是 ________(填字母序号).
A.先通入 CO2 再通入 NH3 B.先通入 NH3 再通入 CO2
(3)上述生产流程中可循环使用的是 ________(填序号).
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(组成确定)
(1)称取一定质量的纯碱样品,多次充分加热,称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀 HNO3,再滴加 AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ________(写化学式).
(含量测定) 同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下三组实验。甲组:取 12.0g 纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。将反应所得溶液小心蒸发,并将所得物质干燥、冷却至室温称得固体质量为 13.1g.样品中碳酸钠的质量分数为________。
乙组:取 12.0g 纯碱样品,利用下图所示装置,测出反应装置 C 增重了 4.1g(所加试剂均足量,每一步都反应完全).实验结束,发现乙组测定的质量分数偏小,其原因是_________。
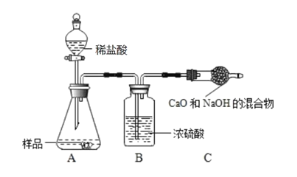
丙组:取 12.0g 的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀过滤、 洗涤、烘干称量固体质量,从而计算出碳酸钠的质量分数。组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 ________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组联系生活实际作了如下探究:
Ⅰ.某同学设计了如图1所示的实验:烧杯中放有燃着的蜡烛和澄清石灰水,并罩上一玻璃杯。
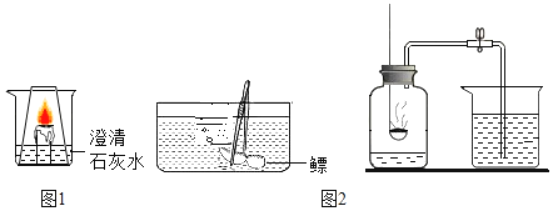
(1)实验观察到的现象是:蜡烛火焰熄灭,且_____。
(2)该同学的实验目的是_____。
Ⅱ.小华对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,并做了如下实验。
(3)将鳔浸在水里剪个小孔,看到一串串气泡冒出,他立即用_____法收集到了甲、乙、丙三瓶气体(连续多次操作)。
(4)将点燃的红磷迅速放入甲瓶中(装置如图2所示),等装置冷却后松开夹子,流入瓶中的水约占瓶子容积的![]() ;往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。红磷燃烧的化学方程式为_____。
;往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。红磷燃烧的化学方程式为_____。
(5)鱼鳔内这两种气体的含量与空气中有什么区别呢?为了探究这个问题,他用空气重复了上述实验,通过对比得出了如下结论_____。
(6)若请你来检验丙瓶内的鱼鳔气体中含有氧气,你的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据以下实验内容,回答相关问题。
[实验目的]证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
[实验原理]____________(用化学方程式表示);
[药品仪器]
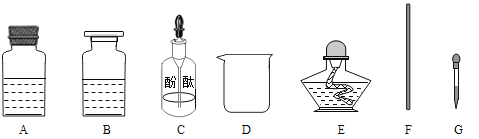
[实验步骤]
①取_______(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用_______(填图中仪器对应字母)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色:
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生。
[思考拓展](1)步骤③的目的是____________;
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是_____________;
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH | <8.2 | 8.2~10.0 | >10.0 |
颜色 | 无色 | 红色 | 无色 |
某同学发现:向某氢氧化钠溶液中滴加酚酞试液后溶液显无色;逐滴加稀盐酸,溶液先变红,后褪至无色。你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是_________;请设计实验证明你的精想(写出简要的操作步骤与现象)_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是()
A. 用氢气还原10g氧化铜,加热片刻后,冷却称得剩余固体质量为8.4g,则参加反应的氧化铜的质量是8g
B. 将5g某物质完全溶解于95g水中,所得溶液中溶质的质量分数一定是5%
C. 将3g碳和6g氧气在密闭容器中点燃,充分反应后,容器中的气体为纯净物
D. 将一定量的氢氧化钠和氢氧化钙的混合物溶于足量水中,再向溶液中加入过量的碳酸钠溶液,充分反应后,生成的沉淀质量与原混合物的质量相等,则原混合物中氢氧化钠的质量分数为26%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】装修材料的大理石,主要成分是![]() ,某同学为了测定大理石中碳酸钙的质量分数进行了如下实验。取定量的大理石样品(研碎)放入盛有100g稀盐酸的烧杯中,大理石样品、稀盐酸和烧杯的总质量为140g克(烧杯的质量为25g)。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表(假设反应匀速进行,杂质不与稀盐酸反应,产生的气体均能全部逸出),请计算:
,某同学为了测定大理石中碳酸钙的质量分数进行了如下实验。取定量的大理石样品(研碎)放入盛有100g稀盐酸的烧杯中,大理石样品、稀盐酸和烧杯的总质量为140g克(烧杯的质量为25g)。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表(假设反应匀速进行,杂质不与稀盐酸反应,产生的气体均能全部逸出),请计算:
反应时间/s | 20 | 40 | 60 | 80 | 100 |
烧杯和药品质量/g | 137.8 | 135.6 | m | 134.5 | 134.5 |
(1)表中的“m”为______g;
(2)该石灰石样品中碳酸钙的质量分数_____。(计算结果精确至0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com