
【题目】下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题:
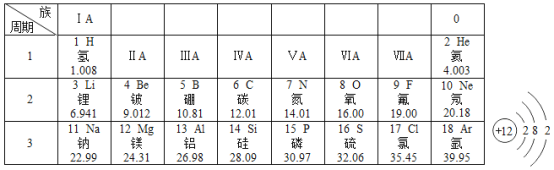
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为_________。
(2)元素周期表中原子序数为12的镁元素原子结构示意图如图所示,该原子在化学反应中易_________(填“得到”或“失去”)电子。说明元素化学性质与原子的_________关系密切。
(3)如图是最新公布中文名称的元素相关信息,下列有关说法正确的是_________。
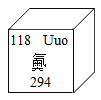
①元素符号为uUO ②该元素属于非金属元素 ③该原子质 量是C-12原子质量的24倍
④原子序数为118 ⑤原子的质子数为176 ⑥相对原子质量为294g
【答案】26.98 失去 最外层电子数 ②④
【解析】
(1)地壳中含量最多的金属元素是铝元素,相对原子质量为26.98。
(2)由元素周期表中原子序数为12的镁元素原子结构示意图可知,最外层电子数为2,该原子在化学反应中失去电子。说明元素化学性质与原子的最外层电子数关系密切。
(3)
①由氦素相关信息可知,元素符号为Uuo,故不正确;
②氦素是“气”旁,该元素属于非金属元素,故正确;
③该原子相对原子质量是C-12原子相对原子质量的294倍,故不正确;
④原子序数为118,故正确;
⑤在原子中,质子数=原子序数,原子的质子数为118,故不正确;
⑥相对原子质量的单位为“1”,相对原子质量为294,故不正确。
故选②④。


科目:初中化学 来源: 题型:
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室利用下图实验装置进行有关化学实验:
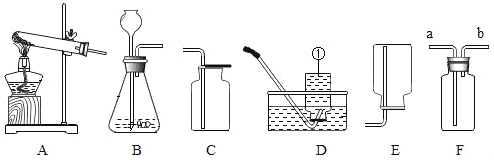
(1)写出仪器①的名称________________。
(2)若用高锰酸钾制取氧气,应选用的发生装置是_______________(填字母),你认为该装置中还缺少___________;写出该反应的化学方程式_______________;若要收集较为纯净的氧气最好选用______________(填字母,在A~E中选取)装置。
(3)用石灰石和稀盐酸反应制取二氧化碳的化学方程式为_______________,应选择制取并收集的装置为A~E中的________________(填字母)
(4)F是一种可用于集气、洗气等的多功能装置,若用向上排空气法收集氧气,气体应该从____________(填"a"或"b")通入F中。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学来源于生活,并为生活服务。用化学知识解释下列生活现象。
(1)硬水危害人们健康,生活中软化硬水的方法是______;
(2)为减少雾霾的吸入,人们出行经常带防雾霾口罩,是利用口罩中填充物(活性炭)的_____性;
(3)厨房调味品中能用来除水垢的物质是_____;
(4)袋装小米中填充氮气保鲜,这是因为_________;
(5)小刚同学在做完二氧化碳的性质试验后,用烧杯罩住两支点燃的、高低不同的蜡烛如图,竟看到了高蜡烛先熄灭的现象,请你帮他解释______________。
(6)“洁厕灵”和“漂白精”是家庭常用的两种清洁剂。“洁厕灵”的有效成分是盐酸,“漂白精”的主要成分是次氯酸钠(![]() ),它们不能混用 ,两者若混合易产生一种有毒气体X,化学方程式为:
),它们不能混用 ,两者若混合易产生一种有毒气体X,化学方程式为:![]() ,则X的化学式为_____。
,则X的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究影响化学反应速率的因素。
(1)[发现和提出问题]
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是______。蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是______;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率。温度如何影响反应速率呢?
(2)[猜想与假设]
温度越高,反应速率越快。
(3)[收集证据]
实验药品:颗粒大小相同的锌粒:两份相同溶质质量分数、不同温度的稀硫酸(20℃、40℃)。
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支。
利用上述仪器和药品,补充完成下表的实验报告。
观察或测量的量 | 实验步骤 | 实验现象 | 实验结论 |
产生相同体积(一试管)的气体所需要的时间 | ①分别取相同数量(或质量)锌粒于两套气体发生装置中 ②______ ③记录收集一试管气体所需的时间 | ④______ | 温度越高、反应速率越快 反应的化学方程式是 ⑤______ |
(4)[结论与解释]
从微观的角度分析“温度越高,反应速率越快"的原因是___________。
(5)[拓展分析]
根据其他测定方法,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示。请据图分析:时间0-t内,反应速率逐渐加快的主要原因是________,时间t以后,反应速率逐渐减慢的主要原因是________________。
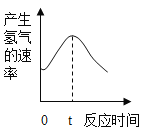
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源。Ⅰ.认识水。(1)我国生活饮用水水质标准规定“铜<1.0mg/L,铁<0.3mg/ L”,其中的铜、铁是指_________(填“元素”或“单质”)。
(2)如图是电解水实验装置,2中得到的气体是_________________,此实验示了水是由____________________组成。
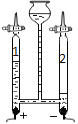
Ⅱ.保护水。每个公民都应该树立保护水资源的意识。下列做法不利于保护水资源的(____________)
a.工业用水净化并重复使用 b.加强城市污水处理系統建设
c.大量超标使用农药和化肥 d.用喷灌、滴灌方法浇灌农田
Ⅲ.利用水。“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如图所示:(③中离子交換树的主要作用是去除重金属离子、软化水质)。
![]()
(3)①中过滤棉的主要作用是_____________(填字母,下同),②中活性炭的主要作用是________。
a.去除有害菌和部分病毒 b.吸附异色异味 c.除去较大的不溶性杂质
(4)若无“生命吸管”,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取_______的方法。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在某铁的样品中,可能含有Zn、Mg、Al、Cu等金属杂质中的2种,取5.6g样品跟足量稀硫酸反应,得到0.20g H2,则此铁的样品中不可能含有的金属杂质是( )
A. Cu和MgB. Zn和AlC. Mg和AlD. Al和Cu
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学课上,老师利用下列装置进行氯化氧与氨气反应的实验,已知:![]() ,
,![]() 常温下为白色固体.
常温下为白色固体.
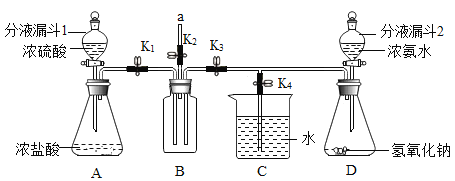
(1)将分液漏斗1中的浓硫酸缓缓放入锥形瓶中,即可产生大量的氯化氢,其原因是________________。
(2)测取并在B瓶中收集氯化氢,需要打开的止水夹是________(填![]() 、
、![]() 、
、![]() 或
或![]() ),然后在a处放置湿润的紫色石蕊纸花,当看到________________,证明已收集满,立即关闭分液漏斗1的活塞和已打开的止水夹.
),然后在a处放置湿润的紫色石蕊纸花,当看到________________,证明已收集满,立即关闭分液漏斗1的活塞和已打开的止水夹.
(3)在a处套一小气球后,打开![]() 、
、![]() ,将分液漏斗2中的浓氨水缓慢演入锥形瓶中,即可产生大量的氨气,观察到B中产生________________现象,关闭分液漏斗2的活塞和K3。
,将分液漏斗2中的浓氨水缓慢演入锥形瓶中,即可产生大量的氨气,观察到B中产生________________现象,关闭分液漏斗2的活塞和K3。
(4)一段时间后打开![]() 、
、![]() ,观察到的现象是________________________。
,观察到的现象是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化碳与我们生活息息相关,兴趣小组利用图中装置进行多角度探究。
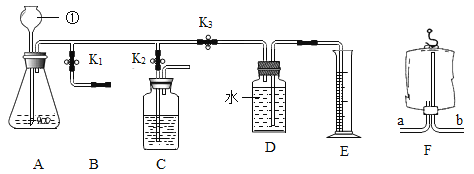
探究一 气体的制取
(1)写出图E中主要仪器的名称:__________________。
(2)用装置A制取二氧化碳的反应化学方程式是__________________。若装置A用于实验室制取氧气,则反应化学方程式是__________________。
(3)生活中有许多物品可以代替实验仪器。关闭![]() 和
和![]() ,打开
,打开![]() ,若用装置F所示的医用塑料袋排空气法收集
,若用装置F所示的医用塑料袋排空气法收集![]() ,则F装置________(填“a”或“b”)端与B装置相连。
,则F装置________(填“a”或“b”)端与B装置相连。
探究二 气体的性质检验
打开![]() 、关闭
、关闭![]() 和
和![]() ,用于检验制取的二氧化碳性质。
,用于检验制取的二氧化碳性质。
(4)若装置C中是紫色石蕊试剂,可证明二氧化碳与水发生了反应,则该反应的化学方程式是_______________。若装置C中的试剂可以检验二氧化碳,则该试剂是_____________。
探究三 测定气体生成的反应速率
关闭![]() 、
、![]() ,打开
,打开![]() ,可测一段时间内生成二氧化碳气体的速率。所测得数据如下:
,可测一段时间内生成二氧化碳气体的速率。所测得数据如下:
稀盐酸的体积(mL)(反应前) | 大理石质量(g)(反应前) | E装置收集的液体量(mL) | 反应时间(s) |
50 | 5.0 | 37.8 | 100 |
(5)由实验数据可知,生成![]() 的体积为___________
的体积为___________![]() 。
。
(6)若生成气体的反应速率用公式![]() 表示(
表示(![]() 表示生成气体的体积、
表示生成气体的体积、![]() 表示反应所用的时间),则生成的二氧化碳的速率为_________
表示反应所用的时间),则生成的二氧化碳的速率为_________![]() 。
。
(7)有同学认为,图中的测量方法容易带来误差,请指出造成误差的原因___________________(写一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com