
【题目】为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,以下说法成立的是 ( )
反应前 | 反应后 |
| ||
A | B | C | D | |
|
|
|
| |
A.物质C是由离子构成B.以上4种物质中属于氧化物的是A和C
C.反应中C,D两种物质的质量比是1︰2D.该反应属于置换反应
科目:初中化学 来源: 题型:
【题目】可燃物R是C、H2、CH4、CO或CH4O中的一种。将一定量的R和氧气置于一个密闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | R | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | m1 | m2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | m3 | m4 | m5 |
下列叙述正确的是( )
①m1=1/9m4时,R是H2
②m1+m2=m3时,R是C或CO
③ m3:m4=11:9时,R是CH4或CH4O
④8m3/11+8m4/9+4m5/7≥m2
A. ①②③ B. ①③④ C. ②③④ D. ①②③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。三个小组均可采用如图装置进行实验,记录收集 10mL 氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的 H2O2 溶液、MnO2、CuO、红砖粉末。
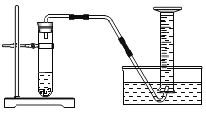
(A 组):探究催化剂对化学反应速率的影响
取 5mL10%H2O2 溶液,三次实验分别加入 0.5gMnO2、红砖粉末、CuO 进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t(秒) | 10 | 60 | 20 |
由此可出结论:MnO2、CuO 对 H2O2 分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为__________。结果:长时间(大于 100s),收集到很少量气体。
更正结论:红砖粉末 _____(选填“有”、“无”)催化作用,三者中 _____催化效率最高。
(B 组):探究浓度对化学反应速率的影响
甲同学:取 10mL5%H2O2 溶液,加入 0.5gMnO2 为催化剂,进行实验,记录时间 t1。 乙同学:取 10mL2.5%H2O2 溶液,加入 0.5gMnO2 为催化剂,进行实验,记录时间 t2。 实验结果 _____。
结论:当催化剂种类相同时,反应物的浓度越大,反应速率越快。
(C 组):探究温度对化学反应速率的影响。
取 10mL5%H2O2 溶液和 0.5gCuO 为催化剂进行实验,两次实验分别将试管置于冰水浴和 50℃热水浴记录时间 t4、t5,且 t4>t5。
结论:当反应物浓度和催化剂相同时,____________。
综上所述:①为了研究某一因素对化学反应速率的影响,必须控制外界其他因素相同.
②探究发现影响化学反应速率的因素有____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是A、B、C三种固体物质的溶解度曲线如图所示,请回答:
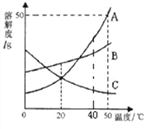
(1)20℃时,A、B、C三种物质的溶解度大小关系是______;
(2)50℃时,向50g水中加入50g A固体,所得溶液中溶质的质量为_______g。
(3)下列说法不正确的是___________。
①将50℃时A、B、C的饱和溶液降温到20℃,溶质质量分数从大到小的顺序是B A=C
②将50℃的C的不饱和溶液变为饱和溶液,溶液质量、溶剂质量、溶质质量分数不一定发生变化
③A中含有少量的B可采用海水晒盐的原理提纯A
④50℃时,将等质量的A、B、C三种物质分别加水完全溶解配制成饱和溶液,A所需要的水最少
⑤分别将40℃时三种物质的饱和溶液降温到20℃,A溶液中析出的晶体最多,C溶液中无晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)下表为部分元素的原子结构示意图:
元素名称 | 氢 | 氦 | 碳 | 氧 | 钠 | 硫 |
元素符号 | H | He | C | O | Na | S |
原子结构 示意图 |
|
|
|
|
|
|
请回答下列问题:
①硫原子的结构示意图的最外层电子数x=_____。
②原子的核外电子排布,特别是最外层的电子数目,与元素的性质有密切的关系。表中具有相对稳定结构的原子是_____(填元素符号)。
③NaH是由离子构成化合物,其形成过程与氯化钠类似。简述NaH的形成过程_____。
④在化学反应中,如果有元素化合价升高,则必定有元素化合价降低。NaH能与水发生化学反应,生成碱和一种气体。甲同学认为生成的气体是O2,乙同学认为生成的气体是H2。从化合价角度分析,你认为哪位同学的说法正确?并说明理由。_____。
(2)汽车尾气催化转换器可将有害气体转化为无害气体排放,其反应过程的微观变化如下图:
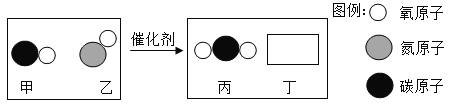
则丁是_____(写化学式),下列说法中正确的有_____。
A 该反应中含氧元素的物质有3种 B 该反应是置换反应
C 参加反应的甲和乙的质量比为14∶15 D 生成丙和丁的分子个数比为1∶1
(3)某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。为确认其组成,取一定量该气体按图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重
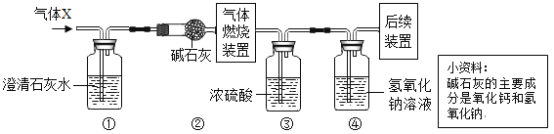
下列关于气体X成分的分析中,正确的有:_____。
A 一定没有二氧化碳 B 可能含有甲烷和氢气
C 可能只有甲烷 D 可能含有氢气和一氧化碳
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁4种常见物质,是由氢、碳、氧、钠、钙元素中的一种或几种组成。
(1)甲是一种由分子构成的单质,其中每个甲分子中含有两个原子,其化学式可能是_____________(填一种即可)。
(2)乙俗称纯碱或苏打,其化学式为_____________。
(3)丙是一种氧化物,遇水放出大量的热,可以在食品包装中作干燥剂。丙的化学式是_______。
(4)丁物质是雪碧汽水中含有的一种酸,其化学式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅酸钠(Na2SiO3)是我国优先发展的精细化工产品。实验室以5g石英砂粉末(其中SiO2质量分数为96%,其余为不溶于水也不与其他物质反应的杂质)为原料,与一定量NaOH溶液反应制取硅酸钠溶液,反应的方程式为:2NaOH+SiO2Na2SiO3+H2O。充分反应后,过滤,得到硅酸钠溶液20g,将滤渣洗涤、烘干,称量质量为2g。
(1)硅酸钠中钠元素、硅元素的质量比为______________________;
(2)2g滤渣中SiO2的质量质量分数___________;(计算结果精确到0.1%)
(3)求把20g硅酸钠溶液,稀释为质量分数为10%的溶液,求需要加入水的质量_____________;
(4)求原氢氧化钠溶液中溶质的质量分数_____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,根据图回答问题
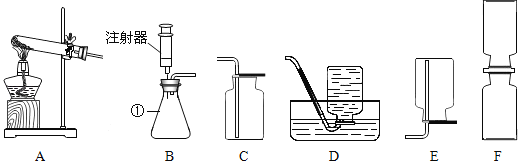
(1)图中标有①的仪器名称是_____.
(2)实验室用高锰酸钾制取并收集较纯净的氧气,应选用的装置是_____(填字母),反应的化学方程式为_____.
(3)已知二氧化氮是一种红棕色气体、密度比空气大,易溶于水.用F装置探究分子运动的实验时,为了尽快观察到实验现象,上瓶装_____,抽去两瓶间的玻璃片,可以观察到的现象是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是()
A. 用氢气还原10g氧化铜,加热片刻后,冷却称得剩余固体质量为8.4g,则参加反应的氧化铜的质量是8g
B. 将5g某物质完全溶解于95g水中,所得溶液中溶质的质量分数一定是5%
C. 将3g碳和6g氧气在密闭容器中点燃,充分反应后,容器中的气体为纯净物
D. 将一定量的氢氧化钠和氢氧化钙的混合物溶于足量水中,再向溶液中加入过量的碳酸钠溶液,充分反应后,生成的沉淀质量与原混合物的质量相等,则原混合物中氢氧化钠的质量分数为26%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com