
【题目】如图为A、B、C三种固体物质(不含结晶水)的溶解度曲线。下列说法错误的是( )

A. t1℃时,三种物质中B的溶解度最大
B. t2℃时,取三种物质各a g分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C. 将三种物质的饱和溶液分别由t2℃降温到t1℃,A溶液中析出的晶体质量最大
D. 可用升高温度的方法使接近饱和的B溶液变为饱和溶液
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:初中化学 来源: 题型:
【题目】下图中的①和②是氟元素和钙元素在元素周期表中的信息,A、B、C、D是4种粒子的结构示意图。请完成下列空白。

(1)钙元素的相对原子质量为_______,氟元素的原子序数为_______;D中的x为_______。
(2)①和②是不同种元素,它们的最本质的区别是_______________________________。
(3)A、B、C、D结构示意图中,属于同种元素的粒子是_______(填字母)。
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似_______(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
I、吕布兰法
1789年,法国医生吕布兰 (N.Leblanc,1742﹣1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
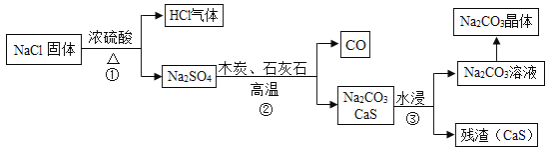
(1)碳酸钠俗称_____。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为 ___________。
(3)③中“水浸”时通常需要搅拌,其目的是________。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
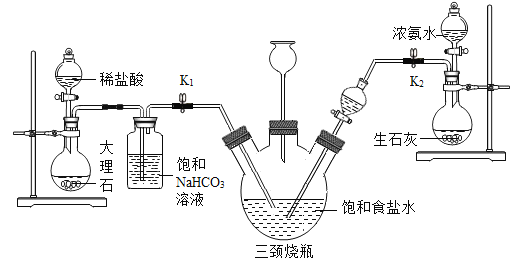
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为_____;
(6)三颈烧瓶上连接的长颈漏斗的主要作用是_____
(7)①根据实验记录,计算t2时 NaHCO3固体的分解率 (已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_________。
②若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____ (填“偏大”、“偏小或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布与众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是_____
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的利用率,它符合当今“绿色化学”的理念。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产生活中有广泛应用。
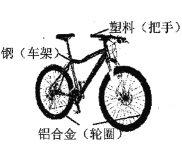
(1)共享单车作为代步工具,既轻便灵活,又环保。下图是一款自行车的图片,所标材料中,车架主要含有的金属元素是________,为防止车架生锈,可以采取的防锈措施是________,铝合金与纯铝相比,其硬度更_______(填“大”或“小”)。
(2)赤铁矿(主要成分Fe2O3)是炼铁的一种矿石,Fe2O3属于_______(填“单质”或“氧化物”)。我国是使用“水法冶铜”最早的国家,请写出铁和硫酸铜溶液反应的化学方程式________________________________。
(3)为了验证Fe、Cu、Ag三种金属的活动性顺序,下列选用的药品可行的是________(填序号)。
①Fe、CuSO4溶液、Ag ②FeSO4溶液、Cu、Ag
③FeSO4溶液、Cu、AgNO3溶液 ④FeSO4溶液、CuSO4溶液、Ag
(4)由两种元素组成的某合金6g与足量的稀硫酸充分反应后,生成0.2g氢气。下列说法不合理的是_________(填字母代号)。
A.合金中的元素可能是Fe和Cu B.所得溶液中的溶质可能是硫酸镁和硫酸
C.合金中的元素可能是Zn和Fe D.所得溶液中的溶质可能是硫酸铝和硫酸
E.合金中的元素可能是Zn和Ag F.所得溶液中的溶质可能是硫酸镁、硫酸铝和硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组利用废硫酸液制备K2SO4

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是一种重要的物质,在日常生活和和生产实践中有着不可替代的作用。
|
|
|
|
图1 | 图2 | 图3 | 图4 |
(1)水的净化
①图1所示净水器可除去水中的色素和异味,是因为其中的活性炭具有_____________性。
②在图1和图2示意的净水原理中,能降低水硬度的净水方法是图______(填“1”或2)。
(2)水的组成。
①图3是水的电解装置,接通直流电源一段时间后,玻璃管b内产生的气体是__________________,该反应的化学方程式为_____________________________。
②电解水的实验中,在玻璃璃管里加含有酚酞的硫酸钠溶液,可以增强导电性。在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈_______(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7,则图4中能表示电解时管b中水在电极端所发生变化得到的粒子是_____(填对应选项的字母)。
(3)水在化学实验中具有重要作用。
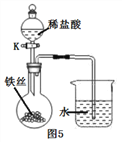
将铁丝放在潮湿的空气中(如图5所示),关闭K,一段时间后,观察到导管内液面上升;打开K,观察到导管内液面下降,导管口有气泡出。请解释导管内液面上升和下降的原因:_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在2014年索契冬季奥运会上,中国运动员共获得了九枚奖牌,成为亚洲体坛霸主。
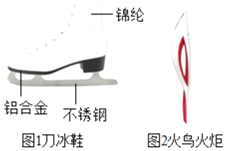
①图1是速度滑冰运动员使用的刀冰鞋,刀冰鞋中含有的金属单质是______(写化学式)。制造刀冰鞋的铝合金材料具有较好的抗腐蚀性,请用化学方程式表示铝在空气中与氧气反应生成致密的氧化膜的过程______。
②图2是2014年索契冬奥会的火炬,火炬外形像神话传说中的火鸟,采集圣火,在太阳光下将火炬燃料喷口伸向凹面镜焦点位置,打开阀门,火炬将被点燃,将燃料喷向凹面镜焦点位置的目的是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号或示意图填空:
两个氢原子______;镁离子的结构示意图______;4个氨气分子______;
硫酸根离子______;氧化铁______;氯化镁中镁元素的化合价为+2价______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示初中化学常见物质间转化关系,(反应条件和部分产物已经省略)A、C是由相同元素组成的液体,C是最常见的溶剂,D、I为气体,其中I能使石灰水变浑,k是红棕色粉末,F、H、L都是黑色固体,L、E是最常见的金属。
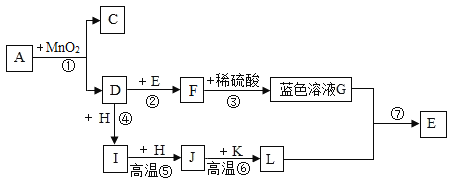
(1)请写出物质化学式C______I______E______。
(2)请写出反应⑥的化学方程式______。
(3)反应⑦基本反应类型是______。
(4)图中①--⑦中属于化合反应的有______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com