
 某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.
某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.| 实验方案 | 实验现象 | 实验结论 |
| 将金属镍加入到盛有硫酸铜溶液的试管中 | 溶液的颜色变浅,有 | 镍比铜的金属活动性强 |


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

| 实验内容 | 实验现象 | 实验结论 |
| 取少量废液缸中的上层清液于试管中,加入过量氯化钙溶液 | 无白色沉淀生成,溶液呈红色 | 呈碱性的物质可能的组成成分是 |
查看答案和解析>>
科目:初中化学 来源: 题型:
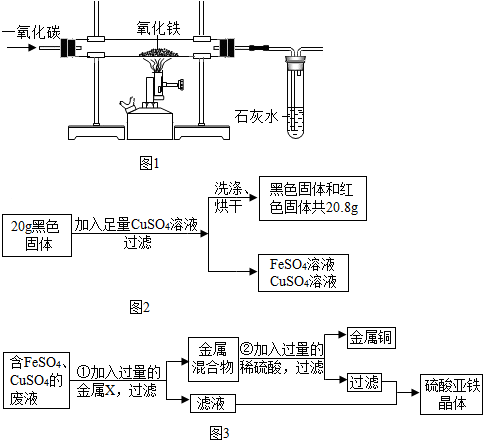
查看答案和解析>>
科目:初中化学 来源: 题型:
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| A、溶液变为不饱和溶液 |
| B、溶质质量分数变小 |
| C、溶液质量变小 |
| D、溶液变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| A、称取5.0g氯化钾,溶解在95 mL水中,充分搅拌 |
| B、称取5.0g氢氧化钙,倒入95mL水中,充分搅拌 |
| C、量取5.0mL浓盐酸,倒入95 mL水中,充分搅拌 |
| D、称取5.0g碳酸钙,放入95mL水中,充分搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com