
【题目】过氧化钙(CaO2)是一种环境友好型供氧剂,可用于鱼类养殖、农作物栽培等,实验室有一瓶放置一段时间的过氧化钙样品,某兴趣小组对其成分展开了如下探究。
(查阅资料)CaO2能与水反应最终生成Ca(OH)2和O2;也能与CO2反应得到CaCO3和O2.过氧化氢溶液具有漂白性。
(提出问题)该固体样品的成分是什么?
(猜想假设)可能是CaO2、Ca(OH)2、CaCO3中的一种或几种。
(实验探究)
实验编号 | 实验步骤 | 实验现象 |
① | 取少量样品于试管中,加入一定量的水,一段时间后,在试管口插入带火星的木条 | 得到浊液,有气泡产生,木条复燃 |
② | 另取少量样品于试管中,滴加适量的试剂X,并将产生的气体通入澄清石灰水 | 得到澄清溶液,有气泡产生,生成的气体使石灰水变浑浊 |
③ | 室温下,取①中上层清液,用pH试纸测定溶液的pH | pH约为12 |
(得出结论)
(1)由实验①②可知,白色固体中肯定有_____。
(2)实验②中所加试剂X可以是_____(填字母序号)。
A 稀硫酸 B 稀盐酸 C 水 D 氢氧化钠溶液
(3)根据实验③_____(填“能”或者“不能”)判断原固体样品中含有Ca(OH)2,理由是_____。
(反思交流)(4)过氧化钙敞口放置在空气中,最终会变质为_____(填化学式),原因是_____。
(改进实验)(5)该兴趣小组在老师指导下,用装置甲进行少量过氧化钙样品与足量水反应的实验,实验时加入过氧化钙样品与足量水,迅速密闭装置,开始测氧气浓度。滴入几滴酚酞试液,观察到三颈烧瓶中溶液先变红后慢慢褪色。620秒时,将气球内二氧化锰加入三颈烧瓶中,瓶内氧气浓度随反应时间变化如图乙。

①AB段氧气浓度几乎不变的原因可能是_____;
②滴入酚酞试液后,三颈烧瓶中溶液变红后会慢慢褪色的原因可能是_____。
【答案】CaO2 和CaCO3 B 不能 样品中的过氧化钙能与水反应生成氢氧化钙 CaCO3 过氧化钙会与空气中的水蒸气反应生成氢氧化钙,氢氧化钙、过氧化钙均能与空气中的二氧化碳反应生成碳酸钙 过氧化钙与水反应先生成过氧化氢和氢氧化钙,没有生成氧气 生成氢氧化钙显碱性,使溶液变红,生成的过氧化氢具有漂白性,使溶液褪色
【解析】
(1)根据实验①中现象,产生使木条复燃的气体,说明生成氧气,则固体中一定有CaO2;根据实验②中现象,产生能使澄清石灰水变浑浊的气体,即生成二氧化碳,则原固体中一定有碳元素,可知固体中一定有CaCO3。由实验①②可知,白色固体中肯定有CaO2 和CaCO3。
(2)A、碳酸钙与稀硫酸反应生成的硫酸钙微溶于水,会覆盖在碳酸钙表面而阻止反应的进一步发生,故A错误;
B、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故B正确;
C、碳酸钙难溶于水,不与水反应,故C错误;
D、碳酸钙不与氢氧化钠溶液反应,故D错误。
故选B。
(3)室温下,取①中上层清液,用pH试纸测定溶液的pH约为12,显碱性,不能判断原固体样品中含有Ca(OH)2,因为过氧化钙与水反应生成氢氧化钙。
(4)过氧化钙与水反应生成氢氧化钙和氧气,过氧化钙与二氧化碳反应得到CaCO3和O2,氢氧化钙与空气中的二氧化碳反应生成碳酸钙和水,过氧化钙敞口放置在空气中,最终会变质为碳酸钙,化学式为:CaCO3。
(5)①过氧化钙与水反应先生成过氧化氢和氢氧化钙,过氧化氢在二氧化锰作催化剂时产生氧气,所以AB段氧气浓度几乎不变。
②氢氧化钙溶液显碱性,能使无色酚酞变红,但过氧化氢溶液具有漂白性,故滴入酚酞试液后,三颈烧瓶中溶液变红后会慢慢褪色。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:初中化学 来源: 题型:
【题目】在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
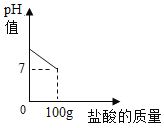
(1)100g稀盐酸中氯化氢的质量 。
(2)完全反应后,计算生成二氧化碳的质量?(写出计算步骤)
(3)完全反应后,所得溶液中溶质的质量分数?(写出计算步骤)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 | 30℃水浴 | 50℃水浴 | 80℃水浴 | 100℃水浴 | 煮沸 |
碘损失率(%) | 0 | 0.3 | 0.67 | 1 | 5.56 |
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计了如下图所示的装置,用于实验室制取 CO2并对它的部分性质进行探究,按要求答题。
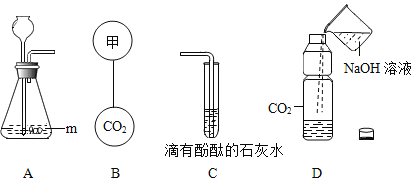
(1)仪器 m 的名称是_____,A 发生反应的化学方程式为_____
(2)若要 B 的两个气球悬浮在空气,则气体甲可能是_____(填序号)
A 空气 B 氧气 C 氢气
(3)往图 C 中的试管通入 CO2,当出现_____现象,表明石灰水的溶质刚好完全沉淀。
(4)向 D 的塑料软瓶倒一定量的 NaOH 溶液,迅速拧紧瓶益,震荡,可观察到瓶子变瘪、若使塑料软瓶恢复原状,可用注射器向瓶注过量的_____(填试标名称)充分反应即可。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 氨碱法生产纯碱的主要反应原理如下:![]() ;2NaHCO3
;2NaHCO3![]() Na2CO3+CO2↑+H2O,下列有关“侯氏制碱法”的叙述中,不正确的是
Na2CO3+CO2↑+H2O,下列有关“侯氏制碱法”的叙述中,不正确的是![]()
A.加热时的稳定性:碳酸钠![]() 碳酸氢钠
碳酸氢钠
B.用食盐制纯碱还需要要含碳、氧元素的物质
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是人类最宝贵的资源。请回答下列问题:
(1)硬水给生活和生产带来很多麻烦,生活中可用_____来区分硬水和软水,常用____的方法来降低水的硬度。
(2)电解水时,连接电源正极端和负极端产生的气体体积之比是 x,电解水的化学方程式中H2和O2的化学计量数之比为y,则x____ (填“>”“<”或“=”)y。该实验可以证明水是由氢、氧两种元素组成的,其理论依据是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,该方法是以从海水中提取出来的食盐为主要原料制取纯碱。其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl; ②2NaHCO3![]() Na2CO3+X+CO2↑;
Na2CO3+X+CO2↑;
试回答下列问题:
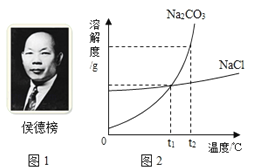
(1)在反应①的六种物质中,能治疗胃酸过多的是 (填化学式)。
(2)在反应②中物质X的化学式是 。
(3)氯化钠和碳酸钠的溶解度曲线如图2,t1℃时,氯化钠饱和溶液溶质的质量分数 碳酸钠饱和溶液溶质的质量分数(填“大于”“小于”“等于”之一)。
(4)t1℃时,一小试管内盛有Na2CO3的饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯中,现将多量的 (填物质名称)加入烧杯内的水中,小试管内的固体物质会逐渐溶解。
(5)当Na2CO3固体中含有少量NaCl时,可采用降温结晶的方法提纯Na2CO3,请说明提纯的原理: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】认识物质的组成和结构,进而能推知物质的性质和用途。
(1)原子结构决定元索性质。
2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号的元素符号为Nh,中文名称为“鉨”。如图甲、乙分别为鉨原子和铝原子结构示意图。请回答下列问题:
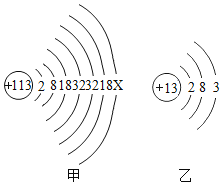
①在化学反应中,鉨原子形成离子的符号为________________。
②根据原子结构,理论上鉨的金属活动性比铝强,你认为可能的原因是________________。
(2)物质组成和结构决定其性质.性质决定其用途。
胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg( OH)2 | AlMg( OH)3CO3 |
构成微粒 | Mg2+、 OH- | Al3+、Mg2+、 OH-、 CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
①Mg( OH)2起抗酸作用的微粒是_______________(填微粒符号,下同);
②铝碳酸镁与盐酸反应的化学方程式为:![]() 。铝碳酸镁起抗酸作用的两种微粒是__________________________________。
。铝碳酸镁起抗酸作用的两种微粒是__________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | m | 0.5g | 0.3g | 0.3g |
计算:
(1)m=______g。
(2)石灰石中碳酸钙的质量分数为______。
(3)2.0g石灰石样品与足量稀盐酸反应,产生二氧化碳的质量是多少?_____(写出解题过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com