
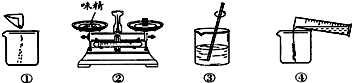
分析 (1)根据溶液质量=溶质质量+溶剂质量,由5.0g味精配制成50g溶液,求出配制时所需水的量,然后根据选取量筒遵循“一次相近”的原则;
(2)根据使用固体物质配制溶液的步骤:计算-称量-溶解,判断实验操作图中操作的顺序;
(3)①溶液中的氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀;可采取再滴加硝酸银溶液的方法,观察是否有沉淀,若无沉淀说明已经沉淀完全;②氯化钠的质量需要根据生成沉淀的质量进行计算,为了使沉淀质量更加精确,需要先过滤,再洗涤干燥称其质量;③仰视读数时,所读出的体积小于实际液体的体积;配制味精溶液只是为了在溶液内进行反应,数据处理与溶液中氯化钠的质量分数无关.
解答 解:(1)取5.0g味精配制成50g溶液,则需要水的质量=50g-5g=45g合45mL,因此需要选择50mL的量筒;故选B;
(2)图①为称量完毕的味精倒入烧杯,图②为称量味精的质量,图③为进行溶解,图④为量取水后倒入盛有味精的烧杯,因此,正确的操作顺序为②①④③;
(3)①氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀,故向清液中再滴加硝酸银溶液,若观察到无明显现象说明原来已经完全沉淀;
③由于实际量取水的体积因仰视而大于配制时所需要水的体积,因此,使所配制的溶液因水量偏大而质量分数偏小;在测定过程后的数据处理中,不需要使用所配制味精溶液的质量分数,因此,并不影响最终的测定结果;
故答案为:(1)B;
(2)②①④③;
(3)①AgNO3;②过滤;③偏小,无影响.
点评 考查了配制溶液的步骤、量筒选取及误差分析,了解相关知识并会灵活应用是解答此题的基础和关键,尤其是量筒的使用对相关问题的影响分析,要细心分析解答.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 将一根未打磨的铝条放入 硫酸铜溶液中 | 无紫红色固体析出 | 铝不如铜活泼 |
| B | 将带火星的木条伸入氧气中 | 木条复燃 | 氧气能支持燃烧 |
| C | 将CO通过灼热的氧化铜 | 黑色氧化铜变成红色 | CO具有可燃性 |
| D | 将氢氧化钠固体加入水中 | 溶液温度升高 | 该反应放热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 豆类、糙米、谷物 | B. | 胡萝卜、水果、猪肝 | ||
| C. | 肉、蛋、奶 | D. | 新鲜蔬菜、黄玉米、黄豆 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
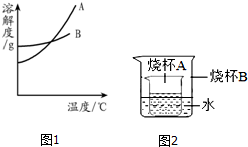 水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:
水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:| 温度/°C 溶解度/g | 0 | 20 | 40 | 60 | 80 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com