
【题目】某项目学习小组用鸡蛋壳进行了如下探究。(鸡蛋壳主要成分是 CaCO3,其他 成分对实验的影响忽略不计)。
(实验回顾)鸡蛋沉浮 将一个新鲜的鸡蛋放在盛有足量稀盐酸的烧杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。将蘸有澄清石灰水的玻璃片盖在烧杯上,石灰水 变浑浊。
(1)鸡蛋出现沉浮现象的原因是______。
(2)石灰水变浑浊的原因是______(用化学方程式表示)。
(实验探究 1)鸡蛋壳溶解 查资料知:电导率越大,溶液导电性越强,离子浓度越大。
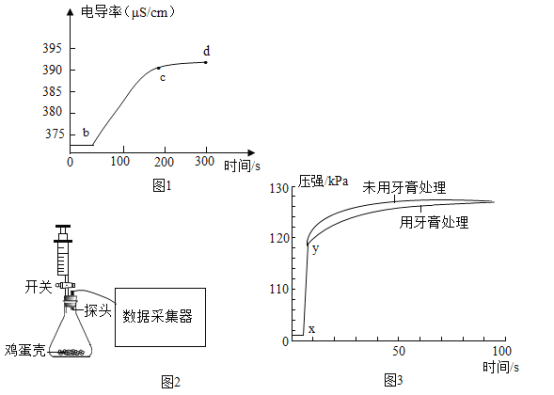
实验设计:在 20℃时,在烧杯中加入蒸馏水,插入电导率传感器,加入蛋壳粉,搅拌,测得 电导率随时间的变化如图 1。
由图 1 可知,下列说法中正确的是______(填字母)。
Aa-b 段说明蒸馏水中含有极少量的 H+和 OH-
Bb-c 段说明蛋壳中的碳酸钙在水中解离出 Ca2+和 CO32-
Cc-d 段说明溶质溶解逐渐达到饱和,离子浓度基本不变
(实验探究 2)鸡蛋壳代替牙齿探究含氟牙膏能否预防龋齿 查资料知:鸡蛋壳、牙齿与含氟牙膏反应的化学原理相似。
(1)氟元素是人体必需的______(填“常量元素”或“微量元素”)。
(2)含氟牙膏(含氟成分为 NaF)与鸡蛋壳中碳酸钙能发生复分解反应,形成更难溶的氟 化钙保护层,反应的化学方程式为______。
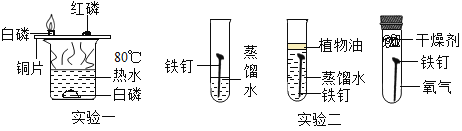
实验设计:先检查图 2 装置气密性,方法是_______。再称取 0.50g“牙膏处理过的蛋壳(用牙膏液浸泡、洗涤、晾干)”于锥形瓶中,用注射器抽 20mL3.5%的盐酸(模拟形成龋齿的酸性环境),连接好装置,打开开关,将盐酸快速压入锥形 瓶,关闭开关;再用“未用牙膏处理过的蛋壳”,重复上述实验。测得压强随时间的变化如 图 3 所示。
(交流与反思)根据图 3 的数据分析,含氟牙膏能否预防龋齿,为什么?______。
(拓展应用)某同学称取 6g 蛋壳粉加入足量的稀盐酸反应,测得产生的二氧化碳质量为2.2g。计算蛋壳中碳酸钙的质量分数。(写出计算过程,结果保留 0.1%)______
【答案】鸡蛋的重力比受到的浮力大,下沉,随着蛋壳表面气泡增多,鸡蛋受到的浮力增大,浮力大于重力时上浮,到接近液面时部分气泡破裂,重力大于浮力又下沉 Ca(OH)2+CO2=CaCO3↓+H2O ABC 微量元素 2NaF+CaCO3=CaF2+Na2CO3 连接装置,外拉注射器活塞,松手后活塞回到原处,说明装置不漏气 能,单位时间内用牙膏处理过的蛋壳产生二氧化碳较少 83.3%
【解析】
[实验回顾]
(1)鸡蛋出现沉浮现象的原因是:鸡蛋的重力比受到的浮力大,下沉,随着蛋壳表面气泡增多,鸡蛋受到的浮力增大,浮力大于重力时上浮,到接近液面时部分气泡破裂,重力大于浮力又下沉。
故填:鸡蛋的重力比受到的浮力大,下沉,随着蛋壳表面气泡增多,鸡蛋受到的浮力增大,浮力大于重力时上浮,到接近液面时部分气泡破裂,重力大于浮力又下沉。
(2)石灰水变浑浊的原因:二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O。
故填:Ca(OH)2+CO2═CaCO3↓+H2O。
[实验探究 1]
A a-b 段说明蒸馏水中含有极少量的 H+和 OH-,选项A正确;
B b-c 段说明蛋壳中的碳酸钙在水中解离出 Ca2+和 CO32-,选项B正确;
C c-d 段说明溶质溶解逐渐达到饱和,离子浓度基本不变,选项C正确。
故填:ABC。
[实验探究 2]
(1)氟元素是人体必需的微量元素。故填:微量元素。
(2)氟化钠和碳酸钙反应生成氟化钙和碳酸钠,反应的化学方程式:2NaF+CaCO3═CaF2+Na2CO3。
检查图 2 装置气密性的方法:连接装置,外拉注射器活塞,松手后活塞回到原处,说明装置不漏气。故填:2NaF+CaCO3═CaF2+Na2CO3;连接装置,外拉注射器活塞,松手后活塞回到原处,说明装置不漏气。
[交流与反思]
根据图 3 的数据分析,含氟牙膏能预防龋齿,这是因为单位时间内用牙膏处理过的蛋壳产生二氧化碳较少。故填:能,单位时间内用牙膏处理过的蛋壳产生二氧化碳较少。
[拓展应用]
设碳酸钙质量为x
![]() x=5g,
x=5g,
蛋壳中碳酸钙的质量分数是:![]()
答:蛋壳中碳酸钙的质量分数是83.3%。


科目:初中化学 来源: 题型:
【题目】结合下图所示实验,回答有关问题。
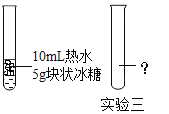
(1)实验一的目的是_____;
(2)实验二的结论:铁生锈是铁与_____共同作用的结果;
(3)实验三在第二支试管中加入_____即可证明温度是影响冰糖溶解快 慢的因素之一。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
(1)从宏观上观察:如右图所示,试管a和b中产生气体的体积比约为_____,b中产生的气体是_________(填化学式)。
(2)从微观上分析:下列说法正确的是______(填字母)。

A.水是由氢气和氧气组成的
B.水是由氢原子和氧原子构成的
C.每个水分子是由2个氢原子和l个氧原子构成的
(3)从符号上表示:电解水的化学方程式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 | 30℃水浴 | 50℃水浴 | 80℃水浴 | 100℃水浴 | 煮沸 |
碘损失率(%) | 0 | 0.3 | 0.67 | 1 | 5.56 |
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,下表物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | CaCO3 | Ca(OH)2 | CaCl2 |
|
B | CuO | H2O | O2 | |
C | NaCl | NaNO3 | NaOH | |
D | CO2 | H2O | H2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计了如下图所示的装置,用于实验室制取 CO2并对它的部分性质进行探究,按要求答题。
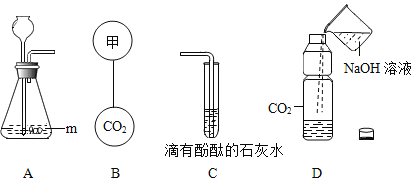
(1)仪器 m 的名称是_____,A 发生反应的化学方程式为_____
(2)若要 B 的两个气球悬浮在空气,则气体甲可能是_____(填序号)
A 空气 B 氧气 C 氢气
(3)往图 C 中的试管通入 CO2,当出现_____现象,表明石灰水的溶质刚好完全沉淀。
(4)向 D 的塑料软瓶倒一定量的 NaOH 溶液,迅速拧紧瓶益,震荡,可观察到瓶子变瘪、若使塑料软瓶恢复原状,可用注射器向瓶注过量的_____(填试标名称)充分反应即可。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 氨碱法生产纯碱的主要反应原理如下:![]() ;2NaHCO3
;2NaHCO3![]() Na2CO3+CO2↑+H2O,下列有关“侯氏制碱法”的叙述中,不正确的是
Na2CO3+CO2↑+H2O,下列有关“侯氏制碱法”的叙述中,不正确的是![]()
A.加热时的稳定性:碳酸钠![]() 碳酸氢钠
碳酸氢钠
B.用食盐制纯碱还需要要含碳、氧元素的物质
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
查看答案和解析>>
科目:初中化学 来源: 题型:
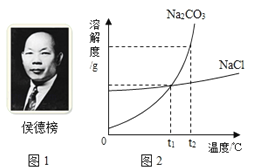
【题目】1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,该方法是以从海水中提取出来的食盐为主要原料制取纯碱。其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl; ②2NaHCO3![]() Na2CO3+X+CO2↑;
Na2CO3+X+CO2↑;
试回答下列问题:
(1)在反应①的六种物质中,能治疗胃酸过多的是 (填化学式)。
(2)在反应②中物质X的化学式是 。
(3)氯化钠和碳酸钠的溶解度曲线如图2,t1℃时,氯化钠饱和溶液溶质的质量分数 碳酸钠饱和溶液溶质的质量分数(填“大于”“小于”“等于”之一)。
(4)t1℃时,一小试管内盛有Na2CO3的饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯中,现将多量的 (填物质名称)加入烧杯内的水中,小试管内的固体物质会逐渐溶解。
(5)当Na2CO3固体中含有少量NaCl时,可采用降温结晶的方法提纯Na2CO3,请说明提纯的原理: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是硅元素在元素周期表中的信息和其原子结构示意图,则下列有关说法错误的是
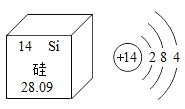
A.硅是地壳中含量最多的非金属元素
B.硅元素位于元素周期表中的第三周期
C.硅的相对原子质量为28.09
D.硅原子核内有14个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com