
【题目】(1) 某无色气体可能含有H2、CO、CH4中的种或几种,依次进行下列实验(假设每步反应或吸收均完全):
①无色气体在足量的氧气中充分燃烧;
②将生成的气体通过盛有浓硫酸的洗气瓶吸收气体中的水蒸气,装置质量增加10.8g;
③再将剩余气体通过盛有足量Ca (OH)2溶液的洗气瓶,装置质量增加13.2g.则该气体的组成情况可能有_____________种 。
(2)等质量的NaCl、KCl、CaCl2,分别与等质量、等质量分数的硝酸银溶液反应,生成沉淀质量(用各物质化学式表示)的大小关系有以下猜测①NaCl= KCl=CaCl2②CaCl2 =NaCl> KCl③CaCl2> NaCl= KCl④NaCl >CaCl2> KCl,其中正确的是___________。
【答案】3 ①②
【解析】
浓硫酸吸收燃烧生成的水而氢氧化钙溶液用于吸收燃烧生成的二氧化碳,浓硫酸质量与氢氧化钠溶液的质量都增加,说明燃烧既生成了水又生成了二氧化碳,结合可燃物完全燃烧的规律,可判断混合气体中含C、H元素。
(1)由生成的气体通过浓硫酸,装置质量增加10.8g,可判断燃烧生成了10.8g水,说明混合气体中含氢元素,且氢元素质量=10.8g×![]() ×100%=1.2g;
×100%=1.2g;
由气体通过氢氧化钙溶液,装置质量增加13.2g,可判断燃烧生成了13.2g二氧化碳,说明混合气体中含碳元素,且碳元素质量=13.2g×![]() ×100%=3.6g;
×100%=3.6g;
计算可知混合气体中C、H元素质量比=3.6g:1.2g=3:1,而甲烷气体中C、H元素质量比=12:(1×4)=3:1,因此可判断混合气体可能只有甲烷;也可能只含有CO和H2;也可能是甲烷、氢气、一氧化碳同时存在,不可能含有甲烷和另外任何一种气体,因此有三种可能。
(2)氯化钠中氯元素的质量分数为![]() ×100%≈61%;氯化钾中氯元素的质量分数为
×100%≈61%;氯化钾中氯元素的质量分数为![]() ×100%≈48%;氯化钙中氯元素的质量分数为
×100%≈48%;氯化钙中氯元素的质量分数为![]() ×100%≈64%;由于加入的NaCl、KCl、CaCl2质量相等,所以对应的氯元素质量最多的是氯化钙,其次是氯化钠最后是氯化钾。由于加入的硝酸银质量不确定,如果硝酸银过量,则三者得到的沉淀的质量顺序为CaCl2> NaCl> KCl。如果量很少,连氯化钾都不足以完全反应,则生成的沉淀的质量为NaCl=KCl=CaCl2;加入的硝酸银多一些,只能完全反应氯化钾,则生成的沉淀质量CaCl2=NaCl>KCl;如果氯化钠也完全反应,而氯化钙没有完全反应,则生成的沉淀质量CaCl2=NaCl>KCl。故选①②。
×100%≈64%;由于加入的NaCl、KCl、CaCl2质量相等,所以对应的氯元素质量最多的是氯化钙,其次是氯化钠最后是氯化钾。由于加入的硝酸银质量不确定,如果硝酸银过量,则三者得到的沉淀的质量顺序为CaCl2> NaCl> KCl。如果量很少,连氯化钾都不足以完全反应,则生成的沉淀的质量为NaCl=KCl=CaCl2;加入的硝酸银多一些,只能完全反应氯化钾,则生成的沉淀质量CaCl2=NaCl>KCl;如果氯化钠也完全反应,而氯化钙没有完全反应,则生成的沉淀质量CaCl2=NaCl>KCl。故选①②。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:初中化学 来源: 题型:
【题目】某同学设计的工业制备氢氧化钠的流程如图。
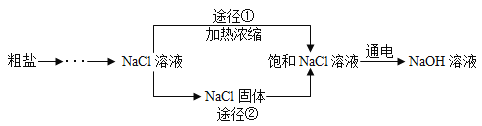
资料:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+Cl2↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)晾晒海水得到粗盐的原理是_______________。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、蒸发皿和_________。
(3)工业生产中应选择途径__________(“①”或“②”),理由是__________。
(4)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为Cl2+2NaOH=NaClO+NaCl+H2O,反应前后氯元素的化合价有________种。
(5)电解水的实验可测定水的组成,不能加入NaCl增强水的导电性的理由是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图所示的是初中化学中的一些重要实验。请回答下列问题:

(1)实验A:倾倒CO2时观察到的现象是 。
(2)实验B:测得空气中氧气体积分数小于1/5的原因可能是(只答一条):
(3)实验C:用玻璃棒搅拌的目的是 。
(4)实验D:集气瓶内放少量水的目的是 。观察到铁丝剧烈燃烧, ,生成黑色固体,放出大量的热。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,通过化学学习,我们进一步认识到水的重要作用。
(1)用加了洗涤剂的水能洗掉餐具上的油污,这是利用了洗涤剂的_________作用。
(2)自然界的水常常遭到人为污染。污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指 ___________(填序号)。
A 元素 B 原子 C 离子 D 分子
(3)下列说法正确的是_______(填序号)。
A 可通过过滤的方法除去受污染水中的可溶性有毒物质
B 水能溶解很多物质,是一种最常见的溶剂
C 水可以灭火,是因为水可以降低可燃物的着火点
D 电解水实验证明了水是由氢元素和氧元素组成的
(4)利用锂与水的反应可制成锂水电池,作为潜艇的储备电源。已知锂与水反应生成一种碱和一种难溶性气体,请写出该反应的化学反应方程式_______________________________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中两个时刻各物质的质量如图所示,图中a、b、c、d分别表示相应物质的质量。下列说法正确的是( )
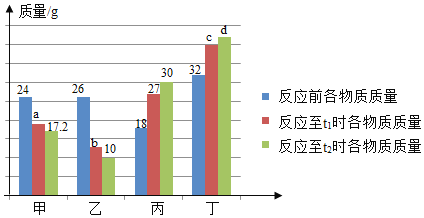
A. b的数值为14
B. 该反应为复分解反应
C. 反应过程中乙与丁发生改变的质量比为5:6
D. 充分反应后生成丙的质量为37.5g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了生活中常见的盐后,化学实验活动课上,互助合作小组同学们做了如下图所示的三组实验。实验结束后,所有同学将A、B、C三支试管中的废液全部倒入一个干净的大烧杯中,静置一段时间,发现杯底有白色沉底,上层溶液呈红色 。
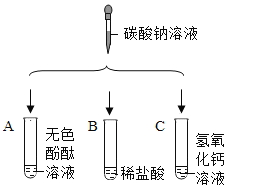
(提出问题)小明同学提出,大烧杯的上层溶液中除了含有水和酚酞外还含有哪些粒子?
(查阅资料) CaCl2溶液呈中性。
(猜想假设)经小组讨论后,同学们作了如下猜想:
①Na+、Cl- 、CO32-
②Na+、Cl-、OH-
③Na+、Cl-、 CO32-、OH-
④Na+、Cl-、Ca2+、OH-
⑤Na+、Ca2+、 CI-、CO32-
小明认为猜想______________不正确,理由是_______________。
(进行实验)同学们对可能存在的离子进行激烈的讨论,一组同学设计了如下方案,对可能存在的粒子进行探究。
实验操作 | 实验现象 | 实验结论 |
取废液少许于试管中,向其中滴加过量的CaCl2溶液 | ____________ | 溶液中一定含有CO32- |
试管中上层清液仍为红色 | 溶液中一定含有_____(写离子符号) |
实验中加入过量的CaCl2溶液的目的是___________________。
(得出结论)猜想___________________正确。
(反思提升)探究废液成分时,需先分析出一定存在和一定不存在的离子,然后再对________进行检验。
(拓展延伸)某纯碱样品中含有少量氯化钠杂质。称取该样品22. 8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。计算所得溶液中溶质的质量分数。(写出解题过程,计算结果精确到0. 1%)________________________
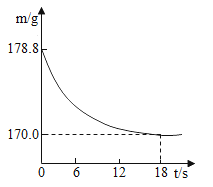
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】新型肺炎的重症患者其肺部功能严重受损,对此有一种医疗手段为气管切开手术,在手术中所用的手术刀锋利无比,其主要是钛合金,金属钛(Ti)的硬度大、熔点高常温下耐酸碱,是航海、医疗等不可或缺的材料钛铁(主要成分FeTiO3)是工业上冶炼金属钛的主要原料,制备全属钛的一种工艺流程如图所示(部分产物略):
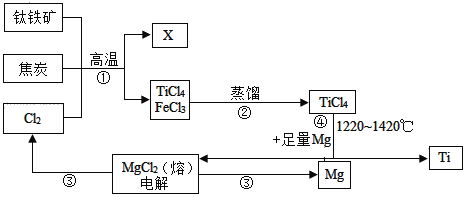
(1)步骤②分离出TiCl4的方法,是利用了TiCl4与FeCl3的__不同。
(2)步骤④的化学方程式为___。
(3)利用上述方法制取的金属钛中可能会含有少量杂质,可用___除去。
(4)依据绿色低碳理念你认为该流程中存在的不足之处是__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一包粗盐,主要成分是氯化钠,其中含少量的硫酸钠、氯化钙和沙子,小轩设计了如图工艺流程,制得精盐。
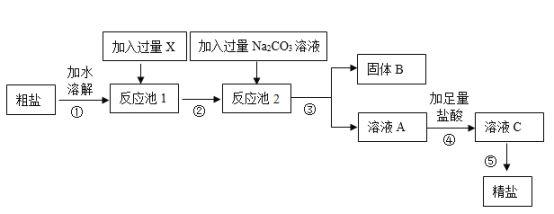
(1)在①-⑤的操作中,属于蒸发操作的是______(填序号),蒸发操作中用于提供热源的仪器是______。
(2)向反应池1中加过量的x是_____溶液(填序号)。
a KOH b NaOH c Ba(OH)2 d Ca(OH)2
(3)固体B中含有的物质有_______(写物质名称,至少写两种)。
(4)第④步加足量盐酸的目的是________。
(5)写出反应池2中所发生的化学方程式:①____、②______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自然界中的碳循环(部分)如图所示。下列有关碳循环的说法中,正确的是_____(填序号)。
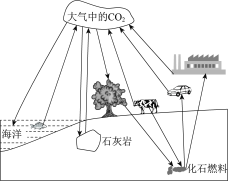
A 碳循环中的“碳”指碳单质
B 碳循环对于保持自然界平衡具有重要作用
C 能吸收碳的自然资源主要有海洋、森林、土壤等
D 化石燃料的大量使用会使大气中二氧化碳的含量不断增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com