
【题目】黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,利用如图实验可制取补血剂原料碳酸亚铁并回收铜。
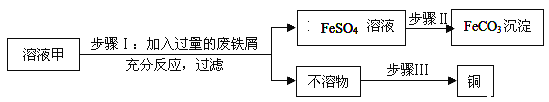
(1)步骤Ⅰ中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe![]() 3FeSO4;
3FeSO4;
②_________________________;
③_________________________。
(2)步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是_____________(填化学式)。
(3)步骤Ⅲ回收铜的实验操作包括:①过滤、②洗涤、③加足量稀硫酸、④干燥,正确的操作排序是____________(填序号)。
(4)若废铁屑含有少量铁锈,对达成实验目的______(填“有”或“无”)影响。
(5)查资料可知,Fe2+在空气中可氧化成Fe3+,为防止FeSO4溶液在空气中氧化,可在溶液中加入少量___________ 。
【答案】 Fe+H2SO4=FeSO4+H2↑ Fe+CuSO4=Cu+FeSO4 Na2CO3/K2CO3 ③①②④ 无 铁粉。
【解析】(1)Fe2(SO4)3、CuSO4及H2SO4都能与铁反应,反应的方程式为:Fe+H2SO4=FeSO4+H2↑; Fe+CuSO4=FeSO4+Cu;
(2)步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是Na2CO3,碳酸钠与硫酸亚铁反应生成碳酸亚铁沉淀;
(3)步骤Ⅲ回收铜的实验操作因不溶物中含有铜和铁,先加足量稀硫酸,与铁反应,然后过滤则不容的部分为铜,再经过洗涤、干燥得到铜;
(4)溶液中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;
(5)FeSO4被氧化而变质,应加入具有还原性的物质,且溶液配制中不能引入新的杂质,所以加入少量的铁粉。


科目:初中化学 来源: 题型:
【题目】金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是_____(填序号)。
A.铂金饰品 B.铁锅 C.铝导线
(2)生活中的铝合金比纯铝的硬度_____(填“大”或“小”);铁制品锈蚀的过程,实际上是铁跟空气中的氧气和______________发生化学反应的过程。
(3)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是_____(填化学式)。
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是_____(填化学式)。
(4)将足量的稀盐酸加入一定量的铁、铜混合物中,下图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是_____(填序号)。

(5)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生。对于产生气泡的“异常现象”,下列猜想不合理的是____(填序号)。
A.产生的气体可能是H2 B.产生的气体可能是CO2
C.CuSO4溶液中可能含有少量的某种酸 D.CuSO4溶液的pH 小于7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是X、Y两种元素的原子结构示意图,据图分析,下列判断不正确的是
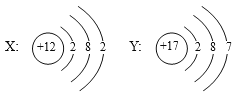
A. Y是非金属元素
B. X元素的原子在化学反应中易失电子
C. X和Y可以形成化合物XY2
D. X、Y两种元素的化学性质很相似
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是硝酸钾和氯化钠的溶解度曲线图,请回答:

(1)P点表示的含义是__________________________________;
(2)20℃时向50g水中加入25g硝酸钾,充分溶解后所得溶液为________溶液(填“饱和”或“不饱和”);请计算此时溶液的溶质的质量分数,写出计算过程,结果保留1位小数;
(3)将饱和的KNO3溶液倒入小试管中,然后放入盛水的烧杯中,当向水中加入某物质后,试管中有晶体析出(如图)。加入的物质可能是下列中的__________(填字母序号)。

A.氢氧化钠固体 B.生石灰固体 C.冰块
D.硝酸铵固体 E.浓硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图。下列说法正确的是( )

A. c和d所含质子数不同 B. 钠、氯都属于金属元素
C. 氯的相对原子质量是35.45 g D. 粒子a和d形成的是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com