

分析 (1)化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)试管中含有二氧化碳;
二氧化碳能使澄清石灰水变浑浊;
草酸受热分解生成水、一氧化碳和二氧化碳;
碱石灰能够吸收水蒸气和二氧化碳.
解答 解:(1)由H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+H2O可知,每个草酸分子中含有2个碳原子和4个氧原子,每个二氧化碳分子中含有1个碳原子和2个氧原子,如果再生成水,则无法配平,因此从理论上就可判断第三种假设不成立.
故填:质量守恒定律.
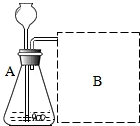
(2)①甲同学按A装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断不严密,因为试管中的空气中含有二氧化碳,加热时试管中的二氧化碳受热膨胀进入澄清石灰水中,能使澄清石灰水变浑浊.
故填:不严密.
②乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊.在尖嘴管口点燃剩余气体,火焰上方罩一个内壁涂有澄清石灰水的烧杯,有白色固体生成,证明产物中有一氧化碳;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明产物中无H2.
故填:内壁涂有澄清石灰水的;一氧化碳.
(3)①草酸受热分解生成水、一氧化碳和二氧化碳,反应的化学方程式为:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2+CO↑+H2O.
故填:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2+CO↑+H2O.
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步都反应完全),方法是:称量实验前后盛有碱石灰的干燥管的质量,如果质量增加,则反应生成了二氧化碳,反之则没有产生二氧化碳.
故填:称量实验前后盛有碱石灰的干燥管的质量.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.
研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.| 实验编号 | 1 | 2 |
| 反应物 | 6%H2O2 | 6%H2O2 |
| 催化剂 | 1g红砖粉 | 1gMnO2 |
| 时间 | 152秒 | 35秒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
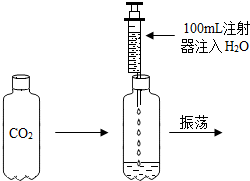 设计了如图所示的实验:一个密封的饮料瓶装有二氧化碳气体,然后用注射器向瓶内注入100mL的水,实验过程中始终保持密封.请你根据生活经验及所学的知识,结合实验回答下列问题:
设计了如图所示的实验:一个密封的饮料瓶装有二氧化碳气体,然后用注射器向瓶内注入100mL的水,实验过程中始终保持密封.请你根据生活经验及所学的知识,结合实验回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 含有氧元素的化合物称为氧化物 | |
| B. | 同种元素组成的物质一定是纯净物 | |
| C. | 质子数相同的粒子一定是同种元素 | |
| D. | 多种元素形成的纯净物一定是化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
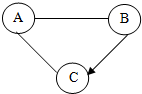 A、B、C为初中化学常见物质,既他们之间有如下图所示关系(“-”表示两种物质间能发生反应,“→”表示两种物质间能够转化,部分反应物或生成物以及反应条件已略去).
A、B、C为初中化学常见物质,既他们之间有如下图所示关系(“-”表示两种物质间能发生反应,“→”表示两种物质间能够转化,部分反应物或生成物以及反应条件已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com