
【题目】某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示:请回答下列问题:
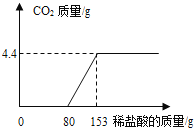
①反应生成的气体质量为______g;
②该废水中Na2CO3的质量分数___和所用稀盐酸溶质的质量分数___。(写出计算过程)?
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:初中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为: H2C2O43H2O  CO2 ↑ + CO ↑ + 4H2O。工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某化学兴趣小组的同学利用草酸晶体制备一氧化碳,通过如下装置测定铁红中铁元素的质量分数。(装置气密性良好,试剂均足量。)
CO2 ↑ + CO ↑ + 4H2O。工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某化学兴趣小组的同学利用草酸晶体制备一氧化碳,通过如下装置测定铁红中铁元素的质量分数。(装置气密性良好,试剂均足量。)
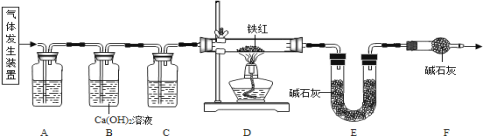
(1)下列可用作草酸分解制取气体的装置是__________(填字母编号)

(2)写出D装置中一氧化碳还原氧化铁的化学方程式____________。
(3)称取质量为m的铁红样品,用上述装置进行实验,测定铁红中铁的质量分数。
①反应结束后D中得到Fe粉的质量x,则x的取值范围为____________(用m的代数式表示)。
②若充分反应后,称得E装置增重n,则此铁红中铁的质量分数是_________(用m、n的代数式表示)。
(4)关于该实验,下列说法正确的是_____________。
①进入D中的气体是纯净、干燥的CO,则A、C中的试剂分别是浓硫酸和澄清石灰水
②对D装置加热前和停止加热后,都要通入过量的CO,其作用都是防止爆炸
③装置F的作用是防止空气中的二氧化碳和水蒸气进入到装置E中
④实验装置有一明显的缺陷是没有尾气处理装置
⑤若没有装置C,则测定的铁元素的质量分数会偏大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用的气体发生装置如图一所示。
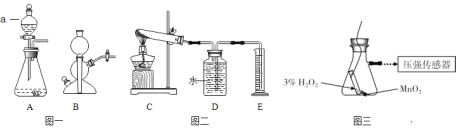
(1)仪器a的名称___;
(2)含溶质6.8g的过氧化氢溶液完全分解,可以生成___克氧气;
(3)用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是______(选填装置编号);
(4)加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是__;有关该实验的说法合理的是__(选填编号);
a.实验开始前装置D中必须装满水
b.先连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D 装置,防止液体倒流
(5)某老师设计图三装置探究二氧化锰的质量对过氧化氢溶液分解反应的影响。
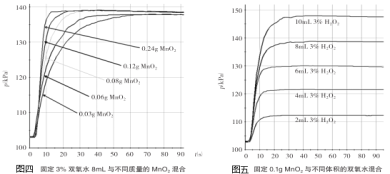
探究Ⅰ.每次固定取用双氧水溶液(3%)8mL分别与不同质量的二氧化锰混合,记录容器内压强的变化于图四中。当二氧化锰的用量增加到0.08g后,曲线的斜率(即表征催化反应的速率)基本上就一致了。因此能快速催化的二氧化锰的最小用量与过氧化氢的质量比约为___(双氧水溶液的密度近似为1g/mL),二氧化锰的质量很小时,反应速率慢的原因是___。
探究Ⅱ.每次固定取用0.1g二氧化锰分别和不同体积的3%的双氧水溶液混合,记录容器内压强的变化于图五中,当双氧水溶液的体积由2mL增加到___mL时,与探究Ⅰ中反应速率相近。该实验说明生成氧气的质量与___的质量成正比。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。
已知:温度过高过氧化物会分解生成氧化物和氧气。
方法1:由Ca(OH)2为原料最终反应制得,其制备流程如下图:
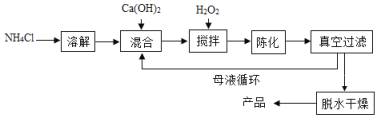
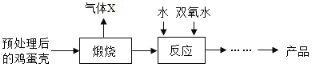
方法2:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下图:
(1)方法1中搅拌的目的是_____________。请将搅拌过程中发生反应的化学方程式补充完整:CaCl2+H2O2+2NH3H2O+6________=CaO28H2O↓+2NH4Cl,反应完全后过滤、洗涤,若要检验沉淀是否洗涤干浄,可向最后一次洗涤液中加___________。方法1制备过程中除水外可循环使用的物质是________________________(填化学式)。
(2)方法2中煅烧后的反应是化合反应,也能生成CaO28H2O,反应的化学方程式为_____________。该反应需控制温度在0~2℃,可将反应器放置在_____________中,获得的CaO2产品中主要含有的固体杂质是___________(填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度不宜过高除了防止氨水挥发外,还能______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C三种物质的溶解度曲线如右图所示。下列分析正确的是
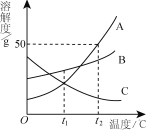
A. t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1∶3
B. t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
C. 将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D. 将C的饱和溶液变为不饱和溶液,可采用升温的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】配制100g 10%的氯化钠溶液的操作过程如图所示。
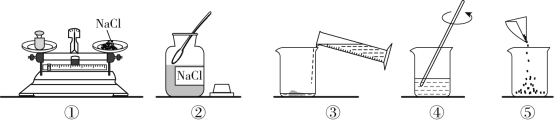
(1)其中操作错误的是_____(填序号)。
(2)若操作正确,配制溶液的正确操作顺序为_____(填序号)
(3)量取水时,应选用_____(填“10mL” “50mL”或“100mL”)的量筒。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式符合事实且书写正确的是( )
A. 高温煅烧石灰石制取生石灰:CaCO3![]() CaO+CO2↑
CaO+CO2↑
B. 用稀硫酸洗去附着在试管壁上的铜:Cu+H2SO4=CuSO4+H2↑
C. 工业上冶炼铝:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
D. 测量空气中氧气含量:Cu+O2![]() CuO
CuO
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文:![]() 身轻顽皮的锂
身轻顽皮的锂![]()
锂是一种活泼金属,它质地很软,可以用小刀轻轻切开,新切开的锂有银白色的金属光泽,别看它的模样跟有些金属差不多,性格特点可不同一般哩![]() 首先它特别的轻,是所有金属中最轻的一个。其次它生性活泼,爱与其他物质结交。它是唯一的与氮气在室温下反应,生成氮化锂
首先它特别的轻,是所有金属中最轻的一个。其次它生性活泼,爱与其他物质结交。它是唯一的与氮气在室温下反应,生成氮化锂![]() 的碱金属。遇水反应生成氢氧化锂
的碱金属。遇水反应生成氢氧化锂![]() 化学式
化学式![]() 和一种可燃性气体。氢氧化锂是一种易溶于水的白色固体,有辣味;化学性质与NaOH相似,溶于水后所得溶液能使无色酚酞试液变红,有腐蚀性。显然,对于这样如此活泼的金属锂,要保存它是十分困难的,它不论是在水里,还是在煤油里,都会浮上来燃烧。化学家们最后只好把它强行捺入凡士林油或液体石蜡中,把它的野性禁锢起来,不许它惹事生非。锂在自然界中存在的主要形式为锂辉石,锂云母等,我国江西有丰富的锂云母矿。目前,世界上多数采用电解熔化氯化锂的方法制得金属锂。
和一种可燃性气体。氢氧化锂是一种易溶于水的白色固体,有辣味;化学性质与NaOH相似,溶于水后所得溶液能使无色酚酞试液变红,有腐蚀性。显然,对于这样如此活泼的金属锂,要保存它是十分困难的,它不论是在水里,还是在煤油里,都会浮上来燃烧。化学家们最后只好把它强行捺入凡士林油或液体石蜡中,把它的野性禁锢起来,不许它惹事生非。锂在自然界中存在的主要形式为锂辉石,锂云母等,我国江西有丰富的锂云母矿。目前,世界上多数采用电解熔化氯化锂的方法制得金属锂。
金属锂的应用非常广泛,它主要作为抗痛风药服务于医学界。直到20世纪初,锂才开始步入工业界,崭露头角。如锂与镁组成的合金,能像点水的蜻蜓那样浮在水上,既不会在空气中失去光泽,又不会沉入水中,成为航空,航海工业的宠儿。此外,锂还在尖端技术方面大显身手。例如,氘化锂是一种价廉物美的核反应堆燃料;固体火箭燃料中含有![]() 的锂。
的锂。
![]() 本文介绍了金属锂的结构、性质和_________等方面。
本文介绍了金属锂的结构、性质和_________等方面。
![]() 在锂原子结构中,与锂元素化学性质密切相关的是_____________。
在锂原子结构中,与锂元素化学性质密切相关的是_____________。
A 质子数 B 中子数 C ![]() 核电荷数 D 最外层电子数
核电荷数 D 最外层电子数
![]() 金属锂具有的物理性质有________________________________________。
金属锂具有的物理性质有________________________________________。![]() 至少写三点
至少写三点![]()
![]() 金属锂 ________
金属锂 ________![]() 填“能”或“不能”
填“能”或“不能”![]() 保存在煤油中。
保存在煤油中。
![]() 载人航天飞船中常用LiOH代替NaOH用来吸收航天员呼吸产生
载人航天飞船中常用LiOH代替NaOH用来吸收航天员呼吸产生![]() ,则LiOH与
,则LiOH与![]() 反应的化学方程式为________________________。
反应的化学方程式为________________________。![]() 友情提示:
友情提示:![]() )
)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室里,用如图所示的装置还原氧化铁过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是( )
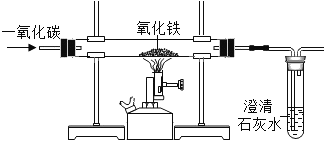
A. 实验时,试管中澄清的石灰水变浑浊证明该反应有CO2气体生成
B. 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁粉
C. 反应后,玻璃管中的固体物质质量比反应前减少了,则减少的质量为CO2气体质量
D. 为了减少空气污染,应增加尾气处理装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com