
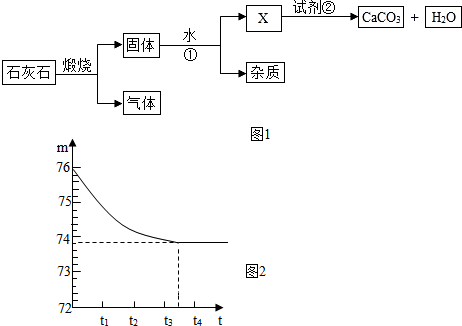
分析 (1)石灰石经高温煅烧可制得氧化钙固体和二氧化碳气体,
(2)氧化钙与水反应生成氢氧化钙,杂质不溶于水,固液分离用过滤法.
(3)石灰石在分解反应中生成氧化钙和二氧化碳,二氧化碳在路线1中又可作为试剂使用,属于循环使用;
(4)根据反应时间曲线可查出碳酸钙完全反应后放出气体二氧化碳的质量,利用生成二氧化碳的质量计算出所取样品中碳酸钙质量,碳酸钙质量与样品质量比即样品中碳酸钙的质量分数.
解答 解:(1)石灰石高温煅烧生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
(2)氧化钙与水反应生成氢氧化钙,杂质不溶于水,用过滤方法可除去杂质,氢氧化钙与二氧化碳反应生成碳酸钙和水,化学方程式为 Ca(OH)2+CO2═CaCO3↓+H2O.
(3)Ca(OH)2+CO2=CaCO3+H2O,在这一反应中,加入的试剂②为CO2,正是石灰石煅烧过程中产生的CO2气体,是循环利用的物质.生成的水可加入①中,故可循环利用的物质是CO2 和H2O;
(4)①根据烧杯内物质的质量的减少求出二氧化碳的质量:76g-73.8g=2.2g,
②设6g样品中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$
x=5g
则该石灰石样品中碳酸钙的质量分数为:$\frac{5g}{6g}$×100%=83.3%
答:该石灰石样品中碳酸钙的质量分数为83.3%
故答案为:(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)过滤;CO2;Ca(OH)2+CO2═CaCO3↓+H2O;(3)CO2 和H2O;(4)2.2;83.3%.
点评 本题主要考查学生对分解反应类型的掌握,了解分解反应的特点,能正确书写方程式.同时体现了“绿色化学”的理念,培养学生的环保意识和节约意识.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蜡烛+氧气$\stackrel{点燃}{→}$二氧化碳+水 | B. | 氢氧化铜$\stackrel{加热}{→}$氧化铜+水 | ||
| C. | 碳酸钙$\stackrel{高温}{→}$氧化钙+二氧化碳 | D. | 氢气+氧气$\stackrel{点燃}{→}$水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学在实验室用以下装置加热高锰酸钾制备氧气并探究氧气的性质.
某同学在实验室用以下装置加热高锰酸钾制备氧气并探究氧气的性质.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 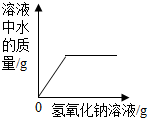 向一定量稀盐酸中加入氢氧化钠溶液 向一定量稀盐酸中加入氢氧化钠溶液 | |
| B. | 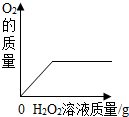 向盛有二氧化锰的烧杯中加入过氧化氢溶液 向盛有二氧化锰的烧杯中加入过氧化氢溶液 | |
| C. | 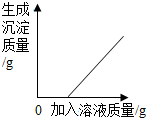 向硝酸银溶液中加入过量的氯化钠 向硝酸银溶液中加入过量的氯化钠 | |
| D. | 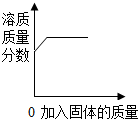 在室温下,向一定量的食盐溶液中不断加入氯化钠固体 在室温下,向一定量的食盐溶液中不断加入氯化钠固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ?③②??④① | B. | ??④?②①③ | C. | ???①②③④ | D. | ??①③②④? |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向收集满CO2的塑料瓶中加入约$\frac{1}{2}$体积的NaCl溶液,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与NaCl反应 |
| B | 50℃时,将17g KCl固体加入50g蒸馏水中,完全溶解后缓慢降温 | 降温至20℃时开始有晶体析出 | 20℃时,KCl的溶解度为17g |
| C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
| D | 点燃从导管放出的某气体,在火焰上方罩一个干而冷的烧杯 | 烧杯内壁有无色液体产生 | 该气体是CH4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com