
【题目】(1)写出下列化学符号:
①3个氯离子______②标出五氧化二磷中磷元素的化合价_____③硫酸溶液中的溶质_______
(2)将空格里要画出的微观示意图填在横线上:

____________________________、_____________________________________
 计算高手系列答案
计算高手系列答案科目:初中化学 来源: 题型:
【题目】下列指定反应的化学方程式正确的是
A. 洗去试管壁上附着的铜: Cu+H2SO4 =CuSO4 +H2↑
B. 铁钉浸入稀盐酸中:2Fe+6HCl=2FeCl3+3H2↑
C. 除去CO2中的CO:2CO+O2![]() 2CO2
2CO2
D. 铜绿的形成:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是甲、乙两种固体的溶解度曲线。若甲中含有少量乙,提纯甲的方法是_____;t2℃时,分别配制150g甲、乙的饱和溶液,所需要固体的质量关系为甲_____(选填“大于”、“小于”或“等于”)乙;t2℃时,将50g溶质质量分数为10%的甲溶液的质量分数变为20%,需要加入甲物质的质量是_____。
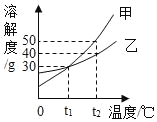
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氰氨基化钙(CaCN2)是一种重要的化工原料,制备CaCN2的化学方程式为CaCO3+2X=CaCN2+CO↑+H2↑+CO2↑.该反应中下列说法正确的是( )
A. 可用氢氧化钠溶液处理有害的气体产物B. 反应后气体质量减少
C. X的化学式为HCNOD. X溶液的![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:
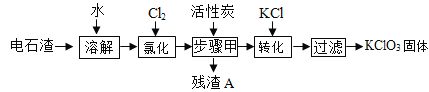
(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A-E五种物质分别是氧化铁、氧气、铁、硫酸铜、一氧化碳中的一种。它们之间的关系如下图所示,相邻物质之间能发生化学反应,且B是一种气体。
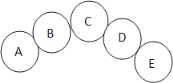
(1)C的化学式为_____,A和B反应的化学方程式为_____
(2)D和E反应的现象是析出_____色固体,溶液变色。要得到同一种溶液,物质D也可以和另一种物质发生反应。写出一条符合要求的化学方程式_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图物质的溶解度曲线,判断下列说法正确的是

A. 将乙的饱和溶液过滤,能得到不饱和溶液
B. t1℃时,甲溶液、乙溶液的溶质质量相等
C. t2℃185g甲溶液降温至t1℃时,能析出49g晶体
D. 将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的同学对铝的相关知识进行探究。
(知识回顾)
(1)铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。下列说法不正确的是 _____。
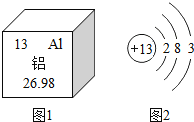
A 铝原子的中子数为13
B 铝离子核外有三个电子层
C 化合物中铝元素通常显+3价
D 铝可作导线是由于它具有良好的导电性
(铝的冶炼)
工业上常用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝,工艺流程如图。氧化铝是两性氧化物,与酸、碱都能发生反应,Al2O3+2NaOH=2NaAlO2+H2O。请回答以下问题:
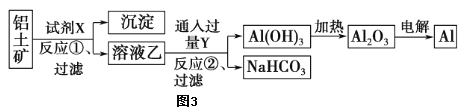
(2)试剂X是_________选填氢氧化钠溶液或盐酸)。
(3)反应①后过滤所得的沉淀是___________。
(4)写出反应②的化学方程式___________________。
(定性研究)
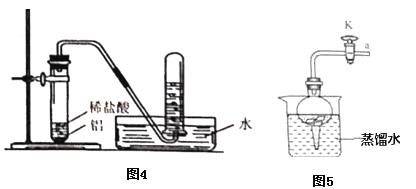
(提出问题)如图所示装置中铝和稀盐酸反应可以制取氢气,那么铝能否与水反应生成氢气呢?
(查阅资料)
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
(交流与讨论)
(5)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用。如生活中可用铝壶烧水。铝与氧气反应的化学方程式为_____________。
(6)除去铝表面氧化铝薄膜的方法有(举一例)_______。除上述方法外,还可以将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
(实验探究)
(7)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中(如图),其表面生成大量气泡、周围出现白色沉淀。若关闭导管上的活塞K,反应停止,其原理是_____________。
(8)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡______(填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
(实验结论)
(9)铝能与水反应生成氢气。写出铝与水反应生成氢氧化铝和氢气的化学方程式____________。
(定量研究)兴趣小组取8g铝镁合金样品,将30g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
剩余固体的质量/g | 5.3 | 2.6 | 2.0 |
(10)该合金中,镁与铝的质量比为 _____。
(11)所用氢氧化钠溶液中溶质的质量分数为多少?(写出计算过程)____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
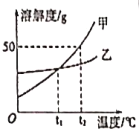
A. t1℃时,甲、乙两种物质的溶液中溶质的质量分数相等
B. 由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C. t2℃时,将40g甲物质加入50g水中.充分溶解后溶液的质量为90g
D. 甲物质中含有少量的乙杂质,要提纯甲物质可以采用降温结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com