
| A�� | ��ë���ڻ��������գ����ŵ�����ëζ��˵����ë�к��е����� | |
| B�� | ���ڰڶ�ʱ�������߶�Խ��Խ�ͣ�˵�����ֻ�е��ת��Ϊ������ʽ���� | |
| C�� | �μ�BaCl2��Һ���а�ɫ�����������Һ��һ����CO32- | |
| D�� | ���ۺ���ǻ�ϼ��Ⱥ��������������������˵�������˻�ѧ�仯 |
���� �������е����ʵ����ʲ����Լ����ʵļ��鷽�����з�����ɣ�
��� �⣺A����ë���ڻ��������գ����ŵ�����ëζ��˵����ë�к��е����ʣ���ȷ��
B�����ڰڶ�ʱ�������߶�Խ��Խ�ͣ�˵�����ֻ�е��ת��Ϊ������ʽ���ܣ���ȷ��
C���μ�BaCl2��Һ���а�ɫ�����������Һ�в�һ����CO32-����������������ӻ��������ӣ�����
D�����ۺ���ǻ�ϼ��Ⱥ��������������������˵��û�������������˻�ѧ�仯����ȷ��
��ѡC��
���� ���⿼����dz��������ʵ������Լ����飬��ɴ��⣬�����������е�֪ʶ���У�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
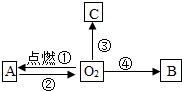 ����֪ʶ������һ����Ҫ��ѧϰ��������ͼ�ǹ���������ѧ���ʵ�֪ʶ���磨��������ʾһ������ת��Ϊ��һ�����ʣ�������B����ʹ����ʯ��ˮ����ǵ����壬CΪ��ɫ���壮��ش��������⣺
����֪ʶ������һ����Ҫ��ѧϰ��������ͼ�ǹ���������ѧ���ʵ�֪ʶ���磨��������ʾһ������ת��Ϊ��һ�����ʣ�������B����ʹ����ʯ��ˮ����ǵ����壬CΪ��ɫ���壮��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

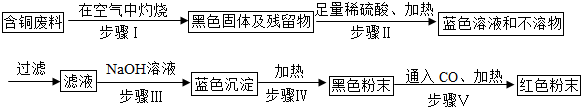
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
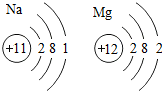 ����֪������Na��Mg���ʲ�ͬ��ԭ����������������ͬ���������ɣ���һ����̼�Ͷ�����̼���ʲ�ͬ��ԭ���Ƿ��ӹ��ɲ�ͬ���������ɣ����ɴ˿ɼ������ʵĽṹ�������ʵ����ʣ�
����֪������Na��Mg���ʲ�ͬ��ԭ����������������ͬ���������ɣ���һ����̼�Ͷ�����̼���ʲ�ͬ��ԭ���Ƿ��ӹ��ɲ�ͬ���������ɣ����ɴ˿ɼ������ʵĽṹ�������ʵ����ʣ�
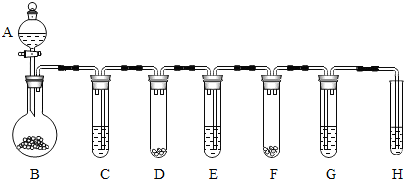
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
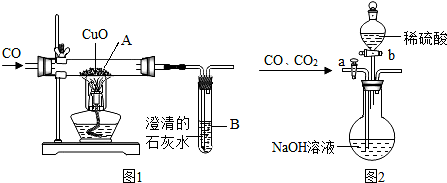
| ʵ�鲽�� | ȡ�����ú�ɫ�������ʢ��ϡ������Թ��У��� |
| ʵ�������� | ����Һ����������������ͭ������Һ��ɫ���䣬����������ͭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��һ�� | �ڶ��� | ������ | ���Ĵ� | ����� | |
| ���봿����Ʒ������/g | 6 | 6 | 6 | 6 | 6 |
| ������ƽ��ʾ��/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ȡ������Һ�μ�����̼�����Һ | ��ɫ���� | ��Һ�к���Ca��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��һ�� | �ڶ��� | ������ | |
| ��ȡ�Ͻ������/g | 10 | 10 | 20 |
| ����ϡ���������/g | 60 | 80 | 50 |
| ��������������/g | 0.2 | 0.2 | ��0.2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com