
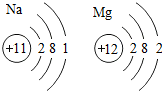
 )推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
)推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.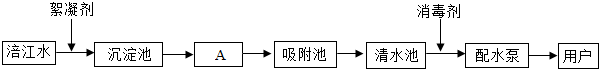
分析 (1)根据元素的性质与原子结构特别是最外层电子数有关,最外层电子数不同,则性质不同,所以金属Na、Mg性质不同进行分析;
根据物质的结构不同,物质的性质不同,CO与CO2的分子结构不同,即一个CO2分子比一个CO分子多一个氧原子,所以CO与CO2的性质不同进行分析;
(2)根据水库中的组成分析类别;
根据过滤的原理分析回答;
根据化合价原则、质量守恒定律分析回答;
利用PH试纸或pH计测定溶液的酸碱度;
根据水垢的成分分析回答;
根据蒸馏的原理及注意的事项分析;
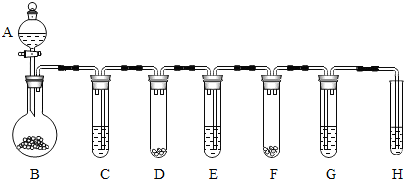
(3)根据石蕊遇酸变红,石灰水遇二氧化碳变浑浊,因此要从反应后的物质考虑反应物;
根据提供的信息和现象推断出每个装置中发生的反应,然后根据反应的特点判断属于那种反应类型.
解答 解:(1)元素的性质与原子结构特别是最外层电子数有关,最外层电子数不同,则性质不同,所以金属Na、Mg 性质不同;
物质的结构不同,物质的性质不同,CO与CO2的分子结构不同,即一个CO2分子比一个CO分子多一个氧原子,所以CO与CO2的性质不同;
(2)①由于水库中的水处于敞开的环境中,混入了一些物质,所以水库中的水属于混合物;
②Ⅰ.A池中通过过滤除去水中的固体杂质;
Ⅱ.在二氧化氯(ClO2)中,由氧-2价,则氯的化合价是+4价;在Cl2+2NaClO2═2ClO2+2X方程式中左边有:氯原子、钠原子、氧原子的数目分别是4、2、2,在右边有氯原子、氧原子的数目分别是2、2、由质量守恒定律反应前后原子的种类及数目不变可知,X的化学式是NaCl;
Ⅲ.为了测定家用自来水的酸碱度,应用PH计来进行精确检测;
③水中的Ca2+,Mg2+受热后转化为沉淀,即通常所说的水垢,水垢的主要成分为碳酸钙和氢氧化镁;
④把自来水进一步净化为蒸馏水的实验方法是蒸馏.实验室制取蒸馏水的蒸馏烧瓶里,通常要加入几粒沸石或碎瓷片,作用是防止出现暴沸;
(3)本实验要多个装置连接,系统的气密性是实验成败的关键,所以,实验开始前首先要检查装置的气密性.此装置的工作原理是B装置中的锌和稀硫酸反应放出氢气,氢气将C装置中的过氧化氢溶液压入D装置中,在二氧化锰的摧化作用下生产氧气,氧气再把E中的液体压入F中,两种药品接触发生反应,生成的气体再通过紫色石蕊试液和澄清石灰水.
①反应开始后,若G中出现红色,H中有白色沉淀生成,说明产生的气体中有氯化氢和二氧化碳,固体和液体反应生成二氧化碳的药品就是盐酸和石灰石;
②通过现象分析,B中是锌和稀硫酸反应,D中是过氧化氢溶液分解,F中是碳酸钙和盐酸反应,G中是二氧化碳和水化合,H中是二氧化碳和氢氧化钙反应,
所以化合反应:CO2+H2O═H2CO3,
分解反应:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
置换反应:Zn+H2S04=ZnSO4+H2↑,
复分解反应:CaC03+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)最外层电子数不同,分子构成不同;
(2)①混合物;
②Ⅰ.过滤;
Ⅱ.+4;NaCl;
Ⅲ.PH计;
③碳酸钙和氢氧化镁;
④蒸馏,防止出现暴沸;
(3)①稀盐酸,石灰石;
②化合反应:CO2+H2O=H2CO3;
分解反应:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
置换反应:Zn+H2SO4=ZnSO4+H2↑;
CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题考查了学生对水的净化、化合价原则、质量守恒定律,酸碱度的测定等知识的掌握和应用,难度不大,掌握相关知识即可顺利解答.


科目:初中化学 来源: 题型:选择题
| A. | 合理使用化肥和农药有利于保护水资源 | |
| B. | 煤气泄露要禁止明火 | |
| C. | 食品袋内充入氮气能延缓食品变质 | |
| D. | 用硫熏蒸使生姜色泽鲜亮 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 羊毛放在火焰上灼烧,能闻到焦羽毛味,说明羊毛中含有蛋白质 | |
| B. | 滚摆摆动时,上升高度越来越低,说明部分机械能转化为其他形式的能 | |
| C. | 滴加BaCl2溶液后有白色沉淀,则该溶液中一定有CO32- | |
| D. | 铁粉和硫磺混合加热后,磁铁靠近不能吸引生成物,说明发生了化学变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
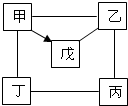 如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )
如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )| 甲 | 乙 | 丙 | 丁 | 戊 | |
| A | Na2CO3 | Ca(OH)2 | NaOH | HCl | CO2 |
| B | HCl | Fe2O3 | H2SO4 | Zn | CuCl2 |
| C | C | CuO | HCl | O2 | CO |
| D | Al | H2SO4 | NaOH | CuCl2 | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用硝酸银溶液区分稀盐酸和稀硫酸 | B. | 用燃着的木条区分氮气和二氧化碳 | ||
| C. | 用稀盐酸区分金属铜和铁 | D. | 用淀粉溶液区分加碘盐和无碘食盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com