
| A. | 用硝酸银溶液区分稀盐酸和稀硫酸 | B. | 用燃着的木条区分氮气和二氧化碳 | ||
| C. | 用稀盐酸区分金属铜和铁 | D. | 用淀粉溶液区分加碘盐和无碘食盐 |
分析 A、根据硝酸银和稀盐酸以及稀硫酸都反应产生白色沉淀分析;
B、根据氮气和二氧化碳都不能燃烧也不支持燃烧进行解答;
C、根据金属的活动性顺序判断二者的反应;
D、根据淀粉只能与单质碘作用而不能与化合态碘反应显色进行解答.
解答 解:A、硝酸银和稀盐酸以及稀硫酸都反应产生白色沉淀,不能用硝酸银溶液来鉴别稀盐酸和稀硫酸,故错误;
B、氮气和二氧化碳都不能燃烧也不支持燃烧,不能用燃着的木条来鉴别它们,故错误;
C、铁位于氢前,能够和稀盐酸产生气泡,而铜不反应,可以鉴别,故正确;
D、淀粉只能与单质碘作用而不能与化合态碘反应显色,加碘盐中的碘为化合态的碘,故错误;
故选项为:C.
点评 本题考查了常见物质的鉴别,在鉴别物质时,要选对试剂,利用物质的特性进行分析.


 能考试全能100分系列答案
能考试全能100分系列答案科目:初中化学 来源: 题型:解答题
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 1%NaCl 溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
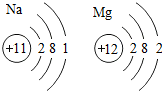 )推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
)推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液滴加适量碳酸钾溶液 | 白色沉淀 | 滤液中含有Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2不能燃烧,也不能支持燃烧 | |
| B. | CO2不能支持燃烧 | |
| C. | 反应生成的固体属于混合物 | |
| D. | 该反应属于化合反应,不属于分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 闭合电路开关前.将滑片移协到滑动变阻器的阻值最大处 | |
| B. | 做中和反应实验时,事先在碱溶液中滴入1~2滴酚酞试液 | |
| C. | 做氢气还原氧化铜实验时,先通一会儿氢气,把试管中的空气排尽 | |
| D. | 稀释浓硫酸时,要将浓硫酸沿容器壁缓慢注入水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com