
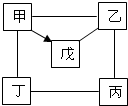
 如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )
如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )| 甲 | 乙 | 丙 | 丁 | 戊 | |
| A | Na2CO3 | Ca(OH)2 | NaOH | HCl | CO2 |
| B | HCl | Fe2O3 | H2SO4 | Zn | CuCl2 |
| C | C | CuO | HCl | O2 | CO |
| D | Al | H2SO4 | NaOH | CuCl2 | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据给出的物质间能否按照框图所示转化或反应判断即可,金属可与酸反应,可与位于其后的金属发生反应;酸可与碱、金属氧化物反应,还可以与某些盐发生反应,碳具有还原性,可以用于还原金属氧化物.
解答 解:A、根据框图,结合A组物质,乙为氢氧化钙,丙为氢氧化钠,这两种物质都属于碱类物质,不能发生化学反应,故A错误;
B、根据框图,结合B组物质,氧化铁不会与氯化铜反应,不符合题意,故B错误;
C、根据框图,结合C组物质,丙为盐酸,丁为氧气,这两种物质不能发生化学反应,故C错误;
D、根据框图,结合D组物质,盐酸可与锌反应生成氯化锌和氢气,锌可与硫酸反应生成硫酸锌和氢气,铁可与氯化铜反应生成氯化亚铁和铜,锌可与氯化铜反应生成氯化锌和铜,盐酸可与氧化铜等物质反应转化为氯化铜,故D正确.
故选:D.
点评 本题综合考查氧气、金属、金属氧化物、非金属氧化物及酸、碱、盐之间的化学反应,要注意酸碱盐之间能否发生反应,需要依据复分解反应发生的条件,完成此类题目,需要熟知常见物质的溶解性.


科目:初中化学 来源: 题型:填空题
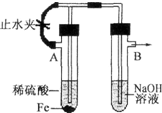 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀.图为Fe(OH)2制备实验的改进装置,原理是首先利用A试管产生的氢气排出B装置中的空气,再利用A中产生的FeSO4和NaOH反应,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀.
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀.图为Fe(OH)2制备实验的改进装置,原理是首先利用A试管产生的氢气排出B装置中的空气,再利用A中产生的FeSO4和NaOH反应,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 从化学原理上讲,这一反应没有违背质量守恒定律 | |
| B. | 甲烷是一种有机物,它能在空气中燃烧 | |
| C. | 二氧化钛是一种金属氧化物,反应前后它的质量不变 | |
| D. | 这一反应是一个化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
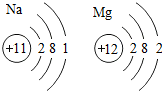 )推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
)推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
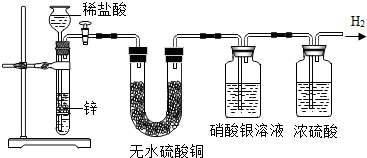
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2不能燃烧,也不能支持燃烧 | |
| B. | CO2不能支持燃烧 | |
| C. | 反应生成的固体属于混合物 | |
| D. | 该反应属于化合反应,不属于分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加入适量硝酸铁溶液 | B. | 加入适量硝酸铜溶液 | ||
| C. | 加入适量硝酸溶液 | D. | 加入适量硫酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com