
分析 (1)据化合物中正负元素化合价的代数和为0进行计算,并据食盐中碘的含量和每天服用的碘的量进行解答;
(2)据氯化银的质量和氯化钠与硝酸银反应方程式可计算出参加反应的氯化钠的质量,并进而计算出氯化钠的质量分数;
解答 解:(1)据化合物中正负元素化合价的代数和为0,碘酸钾中钾元素显+1价,氧元素显-2价,所以碘元素的化合价为+5;食盐含碘的平均值是“30mg/kg”,为防辐射最有效的方法是每天服用碘100毫克,若依靠从碘盐中获取足够的碘来抵挡核辐射,需要每天食用碘盐:$\frac{100mg}{30mg/kg}$≈3.33kg;
(2)设该生理盐水中NaCl的质量为x
NaCl+AgNO3═AgCl↓+Na NO3
58.5 143.5
x 2.87g
$\frac{58.5}{x}$=$\frac{143.5}{2.87g}$
x=1.17g
则该生理盐水中NaCl的质量分数是:$\frac{1.17g}{130g}$×100%=0.9%;
故答案为:(1)+5价;3.33千克;(2)0.9%
点评 注重知识与生活的连接是中考考查热点之一,本题涉及面广,不但要掌握化合物中元素化合价总数和为0,基本的方程式计算,要据题意细心分析解答.


科目:初中化学 来源: 题型:解答题
| 实验一 | 实验二 | 实验三 | |
实验 方案 | 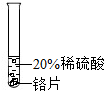 | 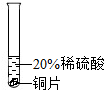 | 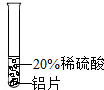 |
| 实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | 无明显实验现象 | 铝片表面产生气泡较快. |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
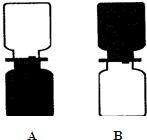 如图A所示,上瓶盛的是空气,下瓶盛的是红棕色的二氧化氮气体(密度在于空气密度).当抽出玻璃片后,会观察到红棕色气体逐渐扩散到上瓶,同时下瓶颜色逐渐变浅,最后,上、下两瓶颜色相同.此现象说明分子在不断运动.当两瓶气体混合后微粒继续(填“继续”或“停止”) 运动.若如图B所示,(填“能”或“不能”)不能说明上述结论,原因是二氧化氮密度大于空气密度.
如图A所示,上瓶盛的是空气,下瓶盛的是红棕色的二氧化氮气体(密度在于空气密度).当抽出玻璃片后,会观察到红棕色气体逐渐扩散到上瓶,同时下瓶颜色逐渐变浅,最后,上、下两瓶颜色相同.此现象说明分子在不断运动.当两瓶气体混合后微粒继续(填“继续”或“停止”) 运动.若如图B所示,(填“能”或“不能”)不能说明上述结论,原因是二氧化氮密度大于空气密度.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验序号 | X的用量/g | Y的用量/g | 生成X2Y的质量/g |
| 1 | 7.4 | 1.6 | 8.0 |
| 2 | 9.6 | 3.2 | 12.0 |
| A. | 3:1 | B. | 4:1 | C. | 2:1 | D. | 37:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
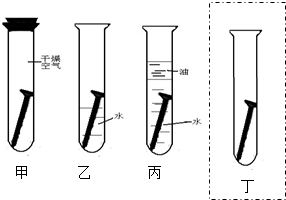
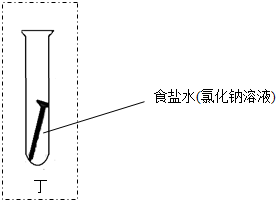 (在丁试管内画图并配适当文字表示就可).
(在丁试管内画图并配适当文字表示就可).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
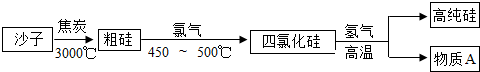
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢 |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量 Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com