
【题目】下列对相应微粒的描述中,不正确的是
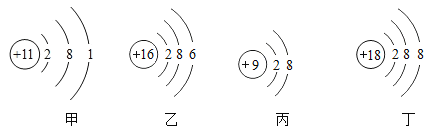
A.微粒甲在化学反应中常显+1价B.微粒乙易形成阴离子
C.微粒丙带正电荷D.微粒丁化学性质比较稳定
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:初中化学 来源: 题型:
【题目】自来水厂净水过程示意图如下。请回答:
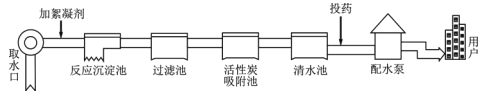
(1)除去水中固态杂质的设备是______(填正确选项前的字母);
A.过滤池 B.吸附池 C.清水池
(2)通常向清水池投放高铁酸钠(化学式为 Na2FeO4)杀菌消毒,高铁酸钠中铁元素的化合价为______;
(3)我国有关部门规定,经上述流程净化后进入用户的饮用水含铁<0.3mg·L-1,含铜<1.0mg·L-1,……。其中的“铁、铜”指的是______(填正确选项前的字母)。
A.原子 B.分子 C.元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D和E是初中化学常见的五种不同种类的物质,其中B为一种红色固体,且A→B的反应过程较为复杂。图中“![]() ”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略)。
”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略)。
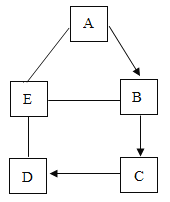
(1)E的化学式可能是____
(2)C→D的反应现象是_____E→B的反应现象为____
(3)A-E反应能发生的原因是______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用,我国化学家侯德榜创立了著名的“侯氏制碱法”,促进了世界技术的发展。
(查阅资料)①生产原料粗盐中含有少量可溶性杂质(MgCl2 和 CaC12)及不溶性杂质。
②氨气极易溶于水,二氧化碳能溶于水。
③生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1,分离得晶体 A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是 NH4Cl===NH3↑+HCl↑。
⑤部分生产流程如下图所示:
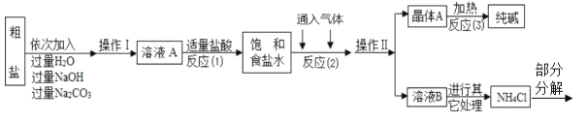
(问 题讨论)
(1)溶液 A 中的溶质为 ________,流程中加入适量盐酸的作用是 ________。
(2)反应(2)中为提高产率,所通入气体的顺序是 ________(填字母序号).
A.先通入 CO2 再通入 NH3 B.先通入 NH3 再通入 CO2
(3)上述生产流程中可循环使用的是 ________(填序号).
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(组成确定)
(1)称取一定质量的纯碱样品,多次充分加热,称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀 HNO3,再滴加 AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ________(写化学式).
(含量测定) 同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下三组实验。甲组:取 12.0g 纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。将反应所得溶液小心蒸发,并将所得物质干燥、冷却至室温称得固体质量为 13.1g.样品中碳酸钠的质量分数为________。
乙组:取 12.0g 纯碱样品,利用下图所示装置,测出反应装置 C 增重了 4.1g(所加试剂均足量,每一步都反应完全).实验结束,发现乙组测定的质量分数偏小,其原因是_________。
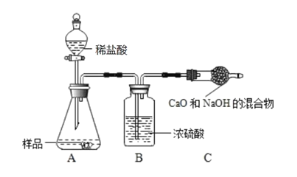
丙组:取 12.0g 的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀过滤、 洗涤、烘干称量固体质量,从而计算出碳酸钠的质量分数。组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 ________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下图所示实验,回答有关问题。
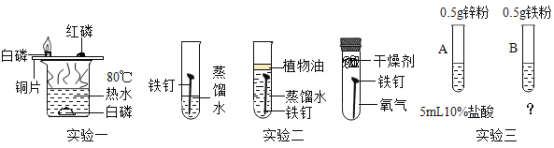
(1)实验一证明可燃物燃烧需要的条件是_____。
(2)实验二的结论:铁生锈是铁与_____作用的结果。
(3)实验三,在B试管中加入_____,即可比较Zn和Fe的活动性强弱。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属制品在日常生活、工农业生产和科学研究方面应用广泛。
(1)①铜质的器皿长期暴露在潮湿空气中会长出一层绿色的铜锈,铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3]。铜的锈蚀是铜与水、氧气共同作用的结果,对于这个结论你认为还应补充的一个重要影响因素是_________(填物质名称)。
②临床上常用含AgNO3的眼药水用于新生儿预防眼炎。取适量该眼药水于试管中,向其中加入适量铜丝,可发生的化学方程式为________________。
③钢铁是应用最普遍的金属材料,请写出一条防止金属生锈的方法:___________。
(2)某小组的同学利用单质铜来进行实验,其设计方案如下:
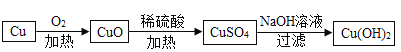
a b c
①b反应中的现象是____________________(写一条即可)。
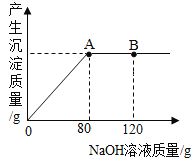
②取一定量的CuO放入盛有一定量稀硫酸的烧杯中,恰好完全反应。向烧杯中逐滴加入10%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液质量的关系曲线如图所示,当滴入10%的NaOH溶液120g时(即B点),此时溶液中的溶质为_________(写化学式)。
③当滴入10%的氢氧化钠溶液80g时(即A点),求沉此时所得Cu(OH)2沉淀的质量_____(计算结果精确至0.1g)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图装置,回答下列有关问题:
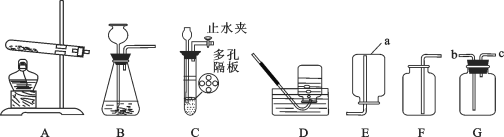
(1)装置图中仪器a的名称为____________。
(2)写出实验室用过氧化氢溶液制取氧气的化学反应方程式_________________,若要得到干燥的氧气,需要在BF装置之间连接一个G装置, G装置应盛装__________,气体应从G装置的________端(选择“b”或“c”)进入。
(3)实验室制取二氧化碳的反应方程式:________________________________ 。
(4)已知甲烷(![]() )是一种无色无味、密度比空气小、难溶于水的气体,实验室常用加热无水醋酸钠固体与碱石灰的混合物来制取,则实验室制取并收集甲烷应选择的装置组合为__________.
)是一种无色无味、密度比空气小、难溶于水的气体,实验室常用加热无水醋酸钠固体与碱石灰的混合物来制取,则实验室制取并收集甲烷应选择的装置组合为__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食品营养与安全关系到每个人的身体健康。
(1)豆浆已成为众多家庭的早餐选择,下表是豆浆中部分成分的平均含量。
成分 | 水 | 蛋白质 | 脂肪 | 糖类 | 钙 | 磷 | 铁 | 维生素 |
平均含量(%) | 96.0 | 1.8 | 0.7 | 1.1 | 0.01 | 0.03 | 0.0005 | 0.015 |
豆浆的成分中能作为机体生长、修补受损组织的原料的是________,人体缺少表中的________元素会引起贫血。
(2)霉变的花生中含有黄曲霉毒素(化学式![]() )食用后可导致癌症。黄曲霉毒素中碳、氢、氧元素的质量比是________。
)食用后可导致癌症。黄曲霉毒素中碳、氢、氧元素的质量比是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列方案设计不能达到实验目的的是( )
选项 | 物质 | 目的 | 主要实验操作 |
A |
| 除杂 | 先通过 |
B |
| 分离 | 溶解、过滤、洗涤、干燥、蒸发 |
C |
| 检验是否变质 | 取样,滴加足量稀盐酸,观察现象 |
D |
| 比较活动性 |
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com