
【题目】已知2CO2+2Na2O2=2Na2CO3+O2,在密闭容器中,将17.6gCO2与少量Na2O2固体充分 反应后,气体变为12g。下列说法正确的是
A. 12g气体全部是O2
B. 12g气体通过足量NaOH溶液后,气体减少8.8g
C. 反应后的固体是混合物
D. 生成Na2CO3的质量为26.5g
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:初中化学 来源: 题型:
【题目】CuCl常用作有机合成催化剂,实验室以初级铜矿粉(主要成分为硫化亚铜(Cu2S)及少量Fe2O3等)为原料制备活性CuCl。实验过程如下:
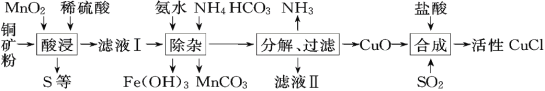
(资料)
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有______(任写一点); “酸浸”过程中发生的化学反应有:①Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O、②______。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是______。
(2)除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③______。
(3)①“分解”实验条件及现象如下表所示。
温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
A | 110 | 101.3 | 60 | 浅蓝色 |
B | 100 | 74.6 | 40 | 很浅 |
C | 90 | 60.0 | 30 | 无色透明 |
则“分解”实验条件应选______(填字母)。
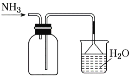
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,当集气瓶收集满NH3时观察到的现象是______。
(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、______。
A 真空干燥 B 在氩气中干燥 C 在空气中烘干
(5)若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克______?(请写出计算过程,结果保留到小数点后一位)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室可用如图A发生装置制备二氧化碳。
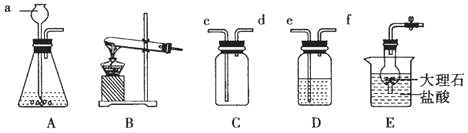
(1)写出锥形瓶中发生反应的化学方程式:_____。
(2)某学生设计B装置制取O2,其选择的反应物为:_____(填化学式)。
(3)仪器a的名称是_____。
(4)若选用C装置收集O2,则O2从_____端导管进入,若用D装置收集O2,则O2从_____端导管进入。
(5)若用E装置制取二氧化碳,优点是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺流程图:
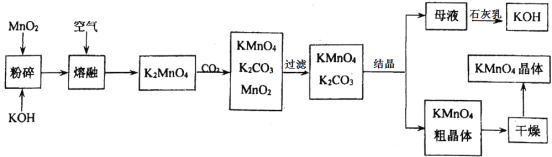
(资料) 在反应过程中有元素化合价变化的反应称为氧化还原反应。在氧化还原反应中,所含元素化合价降低的反应物称为氧化剂,所含元素化合价升高的反应物称为还原剂,且化合价升高总数等于化合价降低总数。
(1)将软锰矿粉碎的目的是_________________;
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要化学反应方程式______;
(3)上述流程中可以循环利用的物质是______;
(4)结晶后,干燥高锰酸钾晶体温度不宜过高的原因是(方程式表示)_____________。
(5)四种基本反应类型中一定不属于氧化还原反应的是_______;
A 化合反应 B 分解反应 C 置换反应 D 复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】宏观和微观相联系是化学独特的思维方式。
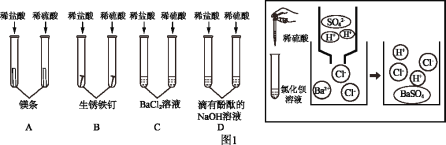
(1)物质性质反映其组成和结构。从宏观进入微观,探索物质变化规律。
①不同酸具有相似的化学性质,但性质也存在差异。图1中不能体现酸的通性的是_____(填字母序号,下同);写出B中稀盐酸与铁锈反应的化学方程式_____;C中稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应生成白色沉淀,据图从微粒的角度分析写出该反应的实质是_____。
②一杯水中氢元素与氧元素的质量比和1个水分子中氢原子与氧原子的质量比_____(填“相等”或“不相等”)。
(2)物质组成和结构决定其性质。从微观进入宏观,探索物质变化规律。
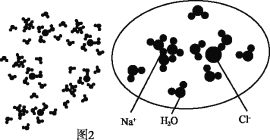
①图2圆圈中表示这杯氯化钠溶液的构成,则该氯化钠溶液中溶质和溶剂的质量比是_____。
②通过分析组成和结构,可以预测物质的某些性质。根据图3硫酸氢钠溶液的微观图示,分析推测NaHSO4的性质,其中合理的是_____。
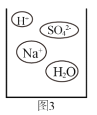
A 其水溶液能使紫色石蕊试液变红
B 其水溶液能与金属锌反应生成氢气
C 其水溶液能与硝酸钡溶液反应生成硫酸钡沉淀
D 其水溶液能与金属镁发生置换反应,得到金属钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验实施绘制如图所示曲线,下列说法正确的是( )

A.a至b段有蓝色沉淀生成
B.d点溶质种类为三种
C.c至d段,溶液pH不断减少
D.c点所含的溶质种类最少
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示:
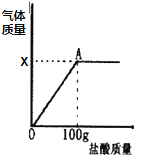
(1)X的值是____
(2)恰好完全反应后,所得溶液中溶质的质量分数___?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的转化关系如图所示。其中A、B、E均为氧化物,其中A可用作食品干燥剂,C、D为不同类别的化合物,D在工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等。它们的转化关系如图所示(“→”表示物质间转化关系,“-”表示物质之间能相互反应。部分反应物、生成物及反应条件已略去)。

请回答:
(1)C的化学式是______,E的一种用途______。
(2)A→C反应过程中会______(填“吸收”或“放出”)热量。
(3)B→E的反应属于______(填反应类型)。
(4)写出E→D反应的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们为了探究氢氧化钙的化学性质,做了如下实验:
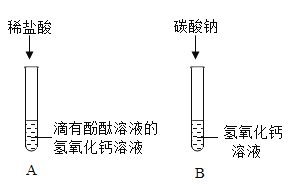
(1)试管A中观察到_____现象时,可证明氢氧化钙溶液与稀盐酸发生了反应。
(2)试管B中发生反应的化学方程式为_____;
(3)实验结束后,二支试管中的液体均为无色。同学们将二支试管中的无色液体倒入同一个洁净的烧杯中,静置一段时间,观察到烧杯底部有白色沉淀,上层溶液为无色。
[提出问题]无色溶液中除酚酞外还有哪些溶质?
[进行猜想]甲同学的猜想:NaCl
乙同学的猜想:NaCl、HCl
分析讨论]①经讨论,大家认为乙同学的猜想不正确,原因是_____;
②丙同学又提出了新的猜想,认为溶液中除氯化钠外,还可能含有_____,请你和丙同学一起验证他的猜想:
实验步骤 | 实验现象 | 实验结论 |
取少量无色溶液于试管_____ | _____ | 丙同学猜想正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com