
【题目】CuCl常用作有机合成催化剂,实验室以初级铜矿粉(主要成分为硫化亚铜(Cu2S)及少量Fe2O3等)为原料制备活性CuCl。实验过程如下:
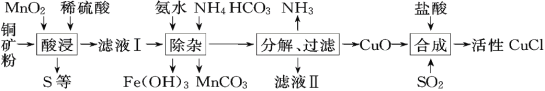
(资料)
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有______(任写一点); “酸浸”过程中发生的化学反应有:①Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O、②______。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是______。
(2)除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③______。
(3)①“分解”实验条件及现象如下表所示。
温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
A | 110 | 101.3 | 60 | 浅蓝色 |
B | 100 | 74.6 | 40 | 很浅 |
C | 90 | 60.0 | 30 | 无色透明 |
则“分解”实验条件应选______(填字母)。
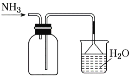
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,当集气瓶收集满NH3时观察到的现象是______。
(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、______。
A 真空干燥 B 在氩气中干燥 C 在空气中烘干
(5)若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克______?(请写出计算过程,结果保留到小数点后一位)
【答案】矿石粉碎或者适当升高温度或者搅拌 CuSO4 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 避免除杂步骤中消耗更多的氨水和碳酸氢铵 使铜离子转化为硫酸四氨合铜[Cu(NH3)4SO4]溶液 C 漏斗中的液面忽上忽下 AB 133.3g
【解析】
(1)酸浸时,由于是固体和液体反应,为了提高浸取率,也就是反应更彻底,可以采取增大反应物接触面积的方法比如矿石粉碎或者搅拌,同时由于温度高一些反应更快更彻底,所以可以适当提高反应温度,在实际操作中可以同时实施。所以可采取的措施有矿石粉碎或者适当升高温度或者搅拌;①根据化学方程式Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O可知,反应前铜原子数为2,硫原子数为5,锰原子数为2,氧原子数为20,氢原子数为8,反应后硫原子数为3,锰原子数为2,氧原子数为12,根据质量守恒定律,在化学反应是原子的数目和种类不变,空格处应为CuSO4;②铜矿粉中含有氧化铁,氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是避免除杂步骤中消耗更多的氨水和碳酸氢铵;
(2)根据流程图可知,除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③使铜离子转化为硫酸四氨合铜[Cu(NH3)4SO4]溶液;
(3)①根据分解条件及现象的表格可知,当溶液呈无色透明时,分解最完全,且用时最少,则“分解”实验条件应选C;
②在实验室用来收集NH3,集气瓶收集满氨时,氨气极易溶于水,使漏斗中气压减小,液面上升,上升后,漏斗与烧杯中液体分离,液面又下降,现象是漏斗中的液面忽上忽下;
(4)CuCl在空气中易被氧化,从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、真空干燥或在氩气中干燥。故选AB;
(5)根据流程图可知,硫化亚铜转化为氯化亚铜过程中,铜元素的没有转化为其他物质,根据质量守恒定律可知,硫化亚铜中铜元素质量等于氯化亚铜中的铜元素质量。
设:若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉质量为x。
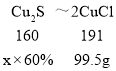
![]() x=133.3g。
x=133.3g。
答:若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉质量133.3g。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】见图,在已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中各加入一定量的等质量、等浓度的稀硫酸,然后在左盘的烧杯A中放入一定质量的Zn片,同时在右盘的烧杯B中放入与Zn片等质量的Fe片。

(1)反应后烧杯B中的溶液变____色。
(2)若锌和93.7g稀硫酸恰好完全反应生成0.2g氢气,则反应后所得溶液的溶质质量分数为_____?(请写出运算过程)
(3)在上述实验中,研判托盘天平指针的最终偏向和药品的剩余情况可用下面的方式 来讨论进行:把反应物的质量处理成粒子数,再通过讨论硫酸分子的数目范围,最 终确定哪种反应情况,具体见下图:

①上图中甲物质是___(填“Zn”或“Fe”)
②当硫酸分子个数为a时,反应结束后,天平指针最终指在分度盘的______填“左边”或“右边”或“正中央”),A、B两杯中反应剩余物质分别是___;
③当硫酸分子个数≥d 时,请描述在整个实验过程中指针的变化情况:____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水的综合利用主要流程如下图。
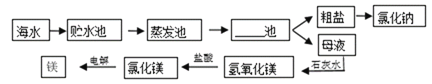
(1)上述工业生产流程图中横线上应该填写______。
(2)根据海水晒盐的工业流程,下列说法中正确的是_____(填字母)
a海水进入贮水池,海水的成分基本不变
b在蒸发池中,海水中氯化钠的质量逐渐增加
c粗盐提纯制成精盐需要用到过滤操作
d母液是氯化钠的饱和溶液
(3)制取金属镁,需要在高温熔化状态下电解氯化镁,写出该反应化学方程式___,该反应需要在氩气或者密闭的环境中进行,理由是___。
(4)如图,A——H是初中化学常见的物质。根据图示回答下列问题。
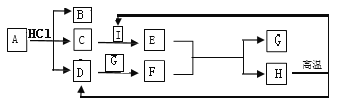
①A物质是焙制糕点的发酵粉主要成分之一,请写出B物质的一种用途____。
②H是常用的建筑材料之一,请写出D与G反应的化学方程式____。
③C与I反应的现象是____。
④该流程没有涉及到的化学基本反应类型是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将160g氧化铁粉末放于硬质玻璃管进行实验室模拟炼铁实验。测得管内剩余固体质量、参与反应的CO质量随温度变化的曲线如图所示,请计算:
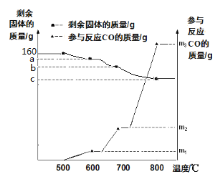
[资料]氧化铁被高温还原是逐步失去氧元素的,其过程为:
![]()
则下列说法正确的是:
A. 当固体质量为a时,参加反应的CO的质量为m3
B. 实验结束后,可用磁铁和稀盐酸检验c处的产物
C. a-b=16
D. m1:m2:m3为1:3:9
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(12分)氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图10所示(固定装置省略)。
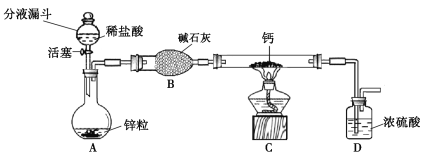
图10
回答下列问题:
(1)装置A中制取氢气的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中制取氢化钙的化学方程式为 。
(4)若不改变温度,整套装置气密性的检查方法是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图11(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为 。(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学校的科学探究小组为了制取二氧化碳气体,选用如图所示的装置,进行了有关实验,回答下列问题:
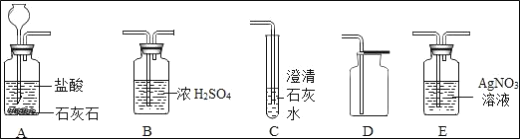
(1)如果要证明制得的气体中混有氯化氢气体,应把A装置与_____装置连接。
(2)如果要验证制得的气体是二氧化碳,应把A装置与_____装置连接。
(3)如果要收集一瓶纯净、干燥的二氧化碳气体,请从上述各装置中选择适当的装置进行连接,连接顺序是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴人的氢氧化钠溶液质量的变化关系如图所示。请计算:
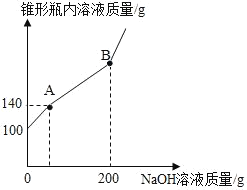
(1)配制质量分数为10%的氢氧化钠溶液200g,需要氢氧化钠的质量是_____g。
(2)计算溶液中氯化铜的质量。_____(写出相应的计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知2CO2+2Na2O2=2Na2CO3+O2,在密闭容器中,将17.6gCO2与少量Na2O2固体充分 反应后,气体变为12g。下列说法正确的是
A. 12g气体全部是O2
B. 12g气体通过足量NaOH溶液后,气体减少8.8g
C. 反应后的固体是混合物
D. 生成Na2CO3的质量为26.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com