
【题目】我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础,生产生活中铁和铁的化合物也有着广泛的应用。
(一)铁的广泛应用
(1)“加铁酱油”中的铁指的是_____(填“单质”或“元素”)。
(2)铁制炊具加热食物,说明铁具有的性质是_____。
(3)铁与铬、镍等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料。以上叙述中没有涉及到_____(填字母)。
A 合金 B 无机非金属材料 C 合成材料 D 复合材料
(二)铁锈成分的探究
(1)下图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是_____(选填序号)。
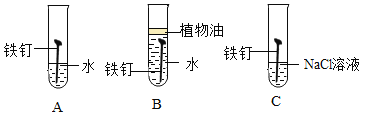
(2)铁生锈的主要过程为:Fe![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3xH2O
Fe2O3xH2O
次要过程为:Fe![]() FeCO3
FeCO3
写出Fe→Fe(OH)2反应的化学方程式_____。
(3)铁锈组分的确定
某铁锈成分为Fe2O3xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用下图装置进行实验。

(查阅资料)①Fe2O3xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2
②温度高于500℃时铁的氧化物才能被CO还原。
(1)装配好实验装置后,首先要_____。
(2)装置A中的反应为:H2C2O4(草酸)![]() CO↑+CO2↑+H2O通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放_____(选填序号)。
CO↑+CO2↑+H2O通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放_____(选填序号)。
a.浓硫酸 b.氢氧化钠溶液
(3)现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g。则样品中FeCO3的质量m(FeCO3)=_____g。
(4)若缺少G装置,Fe2O3xH2O中x的值会_____。(选填“偏大”、“偏小”、“不变”)
(三)炼铁过程的探究
(1)进行上述实验时,应先点燃A装置中的酒精灯,后对D玻璃管加热,原因是_____。
(2)将上述300℃完全分解后的D装置中剩余固体继续升温,当温度高于500℃时,铁的氧化物全部被CO还原得到铁的质量_____克。(计算过程)
【答案】元素 导热性 B C 2Fe+O2+2H2O=2Fe(OH)2 检查装置气密性 b 5.8 偏大 排出装置中的空气,防止发生爆炸 14
【解析】
解:(一)铁的广泛应用
1、“加铁酱油”中的铁指的是元素。
故填:元素。
2、铁制炊具加热食物,说明铁具有的性质是导热性。
故填:导热性。
3、铁与铬、镍等金属熔合可形成“不锈钢”,不锈钢属于合金,聚乙烯纤维属于合成材料,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料属于复合材料。
故填:B。
(二)铁锈成分的探究
1、B中铁钉与氧气隔绝,不容易生锈,A中铁钉和水、氧气接触,容易生锈,C中铁钉与水和氧气接触,容易生锈,同时氯化钠溶液能够促进铁钉生锈,因此最先观察到铁锈的是C。
故填:C。
2、铁和水、氧气反应生成氢氧化亚铁的化学方程式为:2Fe+O2+2H2O=2Fe(OH)2。
故填:2Fe+O2+2H2O=2Fe(OH)2。
3、(1)装配好实验装置后,首先要检查装置气密性。
故填:检查装置气密性。
(2)洗气瓶B中应盛放氢氧化钠溶液,用来吸收二氧化碳。
故填:b。
(3)设碳酸亚铁质量为x,
装置F增重2.2g,说明碳酸亚铁分解生成了2.2g二氧化碳,

![]() =
=![]() ,
,
x=5.8g,
故填:5.8。
(4)若缺少G装置,空气中的水蒸气和二氧化碳会进入F装置,导致计算的碳酸亚铁质量偏大,从而导致Fe2O3xH2O质量偏小,而通过E装置测定的结晶水质量不变,从而导致Fe2O3xH2O中x的值会偏大。
故填:偏大。
(三)炼铁过程的探究
1、进行上述实验时,应先点燃A装置中的酒精灯,后对D玻璃管加热,原因是排出装置中的空气,防止发生爆炸。
故填:排出装置中的空气,防止发生爆炸。
2、Fe2O3的质量为:25.4g﹣3.6g﹣5.8g=16g,
16g氧化铁中铁元素质量为:16g×![]() =11.2g,
=11.2g,
5.8g碳酸亚铁中铁元素质量为:5.8g×![]() =2.8g,
=2.8g,
将上述300℃完全分解后的D装置中剩余固体继续升温,当温度高于500℃时,铁的氧化物全部被CO还原得到铁的质量为:11.2g+2.8g=14g,
故填:14。


科目:初中化学 来源: 题型:
【题目】(1)请用恰当的化学用语填空。
①氖气_____ ②2个二氧化硫分子______ ③n个铝离子_____
④规范表示氨气中氮元素的化合价______ ⑤硫酸根离子 ______。
(2)请从H、C、O、S、Na五种元素中选一种或几种元素,写出符合下列要求的化学式。
①相对分子质量最小的气体是____;②能作为燃料的有机化合物是_____;
③工业炼铁能还原氧化铁的氧化物是___;④焙制糕点所用发酵粉的主要成分之一是 __;⑤溶于水后的稀溶液能使石蕊试液变红的化合物是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学用实验室存放近一年的溶质质量分数为30%H202溶液(如下图一),进行如下实验:
(1)小亮从瓶中取出50mL溶液,稀释成10%的H202溶液待用,理论上他需要加水 __ mL。
(2)小丽同学用上述稀释后的H202溶液和下图二装置探究不同物质对H202的催化效果是否相同。实验中她看到左侧试管比右侧试管中产生气泡的速率快,此外还观察到____,说明Mn02对此反应的催化效果比水泥好。请判断该实验设计是否合理并说明理由:____。
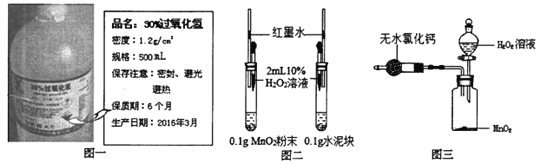
(3)小杰同学用上图三装置测定上述稀释后的H202溶液的溶质质量分数是否为10%,反应前他在分液漏斗中加入50 g稀释后的H202溶液,在干燥管中加入足量无水氯化钙,并在广口瓶中加入适量Mn02样品,共称得装置和药品的总质量力564.57g。打开分液漏斗活塞,使H202溶液全部流入瓶中,迅速关紧活塞,待反应结束后,称得装置及其内所有物质的总质量为562.97g。
①请计算上述稀释后的H202溶液的溶质质量分数与10%是否相符?____(请写出具体计算过程)
②若不符合,其可能的原因是____ 。(注:若符合,此问不作答)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
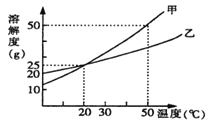
A.20℃时,100g甲溶液中含甲物质的质量小于25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.30℃时,甲物质的溶解度大于乙物质的溶解度
D.50℃时,将甲、乙两种物质的饱和溶液分别降温至20℃,析出晶体的质量甲大于乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象关系合理的是( )
A. 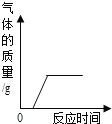 在久置的NaOH溶液中滴加盐酸
在久置的NaOH溶液中滴加盐酸
B. 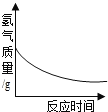 锌加入足量的稀硫酸中
锌加入足量的稀硫酸中
C. 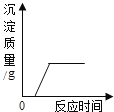 往Na2SO4和HCl的混合溶液中加入Ba(OH)2溶液
往Na2SO4和HCl的混合溶液中加入Ba(OH)2溶液
D. 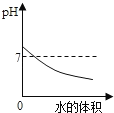 向pH=9的NaOH溶液中不断加水
向pH=9的NaOH溶液中不断加水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学取一块石灰石样品(成分为碳酸钙及20%的不含钙的杂质,杂质不溶于水且不与酸反应)研碎后忘记称量而直接煅烧一定时间后,称量剩余固体的质量为103g,向其加入质量分数为14.6%的稀盐酸发现有气泡产生,恰好完全反应后共用去500g稀盐酸,则已分解的碳酸钙质量占原样品质量的质量分数为
A. 40% B. 50% C. 60% D. 80%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)﹣一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖.磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。
回答下列问题:
(1)一个青蒿素分子中含有 个原子。
(2)青蒿素中的氢元素与氧元素的质量比是 。
(3)14.1克青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)甲、乙、丙三种固体的溶解度曲线如图所示,据图回答:
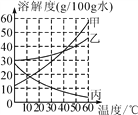
①30 ℃时,丙的溶解度是____;
②50 ℃时,在100 g水中放入50 g乙物质,充分搅拌后所得溶液的溶质质量分数为____(计算结果保留至0.1%);
③若将20 ℃时甲、乙、丙三种物质的饱和溶液升温至40 ℃(不考虑水的蒸发),可析出晶体的是____;
④将50 ℃时甲、乙、丙三种物质的饱和溶液均降温至10 ℃,所得溶液的溶质质量分数从大到小的顺序是____。
(2)常温下欲配置100 g溶质质量分数为10%的乙溶液,操作如图所示。
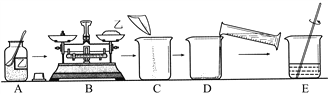
请回答下列问题:
①图中操作有错误的是____(填对应字母)。
②量取水时,若采用仰视的方法读数,会导致所配溶液的溶质质量分数____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com