
【题目】水是重要资源,下列说法不正确的是
A.煮沸和蒸馏均能使硬水转化为软水
B.活性炭的吸附作用可使海水转化为淡水
C.电解水得到的H2和O2质量比为1∶8
D.液态水变成水蒸气,分子间间隔增大
【答案】B
【解析】
A、煮沸和蒸馏过程中都需要加热,在加热过程中可溶性钙镁化合物会转变成难溶于水的碳酸钙和氢氧化镁等物质,水中可溶性钙镁化合物含量降低甚至完全除去,硬水转化为软水,选项A正确;
B、活性炭只能吸附异味、色素等可溶性杂质,不能吸附海水中的钠离子、镁离子、氯离子,而海水淡化是要降低海水中可溶性盐的含量,因此活性炭的吸附作用不能使海水转化为淡水,选项B不正确;
C、电解水的化学方程式是: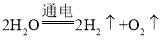 ,根据化学方程式,可以计算出H2和O2的质量比为1∶8,选项C正确;
,根据化学方程式,可以计算出H2和O2的质量比为1∶8,选项C正确;
D、构成物质的分子之间有间隔,液态物质中分子之间的间隔较小,气态物质中分子之间的间隔较大。因此液态水变成水蒸气,分子间间隔增大,选项D正确。故选B。


科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(原文作者:许谦,有删改)
酸奶口感酸甜,营养丰富,是深受人们喜爱的一种乳制品。与普通牛奶比较,酸奶中的蛋白质和钙更易被人体消化吸收,是乳糖不耐症患者的良好食品。
通常的酸奶是将牛奶发酵而制成的。牛奶中主要含有蛋白质、乳糖和脂肪。在发酵过程中,乳酸菌把乳糖(C12H22O11)转化成乳酸(C3H6O3),使得牛奶的酸度升高。随着酸度增加,蛋白质分子互相连接,形成了一个巨大的“网络”,这个“蛋白质网络”把乳糖、水、脂肪颗粒都“网”在其中。所以,奶变“粘”、变“酸”了。

酸奶中含有大量活力较强的乳酸菌。乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收。酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,而酸奶的乳酸积聚又会影响到酸奶的酸度。有研究者选取某种市面常见的酸奶进行实验,数据如下表所示。
表某品牌酸奶酸度的变化
温度/℃ 时间/天酸度/°T | 4 | 28 | 37 |
0 | 67.7 | 67.7 | 67.7 |
2 | 73.9 | 77.1 | 79.2 |
4 | 76.4 | 82.7 | 86.3 |
6 | 85.5 | 92.2 | 98.9 |
8 | 90.2 | 98.7 | 113.2 |
1999年颁布的国标GB2746-1999中,对成品酸奶的酸度规定为“酸度不小于70°T”。按照一般人的接受程度,酸奶酸度不能超过100°T。
依据文章内容回答下列问题。
(1)乳酸是由乳糖转化生成的,请比较二者的化学式,分析它们的相同点和不同点。
相同点:_____。
不同点:_____。
(2)实验中所用酸奶若在37℃条件下储存,_____天后,酸度一定会超出一般人的接受程度。(填字母序号,下同)
A 2 B 4 C 5 D 8
(3)由表中实验数据可知,影响酸奶酸度的因素有_____。
(4)下列关于酸奶的说法正确的是_____。
A 酸奶适用于乳糖不耐症患者食用
B 酸奶放置时间越长,乳酸菌含量越高
C 酸奶中的乳酸菌对人类身体有害无益
D 酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁4种初中化学常见的物质,由氢、碳、氧、钠中的1~3种元素组成。 用如图所示装置和试剂做了以下3个连续实验。

已知:酚酞溶液遇Na2CO3溶液、NaHCO3溶液均呈红色。
(1)打开K,将胶头滴管中的水挤入集气瓶中,振荡集气瓶,观察到烧杯中的导管口有气泡冒出,触摸集气瓶壁,感觉到微热。
① 已知甲为白色固体,有强烈的腐蚀性,易潮解,则甲的化学式为_____。
② 烧杯中导管口有气泡冒出的原因是_____。
(2)关闭K,打开集气瓶塞,将少量黑色固体乙点燃后,立即伸入瓶中,塞紧瓶塞,观察到乙在丙中剧烈燃烧,发出白光。燃烧产物丁分子的微观示意图为![]() ,则丙分子的微观示意图为_____。
,则丙分子的微观示意图为_____。
(3)待乙充分燃烧至熄灭后,冷却至室温,振荡集气瓶后,打开K,观察到烧杯中的溶液沿导管进入集气瓶,瓶中产生大量气泡。
①烧杯中的溶液进入集气瓶后产生气泡的原因_____(用化学方程式解释)。
② 充分反应后,集气瓶内溶液为无色,则溶液中的溶质除酚酞、NaCl外,还可能有_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为甲、乙、丙三种固体物质的溶解度曲线,请回答.
(1)在 ℃时,甲、乙溶解度相等.
(2)甲中混有少量乙,若要提纯甲可采取的结晶方法是 .
(3)t2℃时,丙的饱和溶液中溶质和溶剂的质量比为 .
(4)将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量 (填“一定”或“不一定”)大于乙.

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列各组物质中的少量杂质,所用方法不正确的是:
选项 | 物质 | 杂质 | 除去杂质的方法 |
A | NaCl | Na2CO3 | 加入足量的稀盐酸不再有气体产生,蒸发 |
B | N2 | O2 | 通过红热的铜丝 |
C | KNO3溶液 | Ba(NO3)2 | 滴加适量K2SO4溶液、过滤 |
D | Ca(OH)2 | CaCO3 | 滴入足量稀盐酸至不再产生气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列装置回答问题:
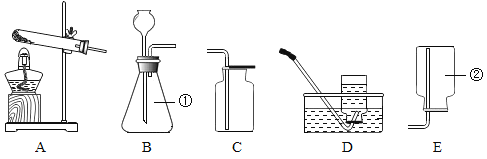
(1)写出①、②的仪器名称:①______________;②_____________。
(2)实验室用高锰酸钾制取氧气的化学方程式为____________,若用B装置制氢气,则B中反应的化学方程式__________。
(3)实验室可用B装置来制取二氧化碳,反应的化学方程式为__________,若用碳酸氢钠固体加热分解(产物为碳酸钠、二氧化碳和水)来制取CO2,应选用的气体发生装置是_____(填字母)。
(4)用E装置可以收集O2、CO、CH4等气体中的_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类文明的发展和社会的进步同金属材料关系十分密切,其中钢铁是基本的结构材料,称为“工业的骨骼”。
(1)自行车的有些部件是由钢铁制成的。钢铁制品被腐蚀的原因,是其与_____接触引起的,为防止自行车链条生锈可采取的措施是_____。
(2)金属锂是密度最小的金属,用于原子反应堆、制轻合金及电池等。锂(Li)的原子结构示意如图1所示,它的化学性质与钠相似,原因是_____。请写出锂与稀硫酸反应的化学方程式:_____。
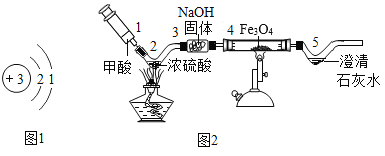
(3)同学们利用自制仪器模拟工业炼铁实验,用图2所示微型实验装置制取CO,然后用CO还原Fe3O4并检验气体产物。已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。
①位置4发生的化学方程式是_____。
②氢氧化钠固体的作用是什么?_____。
③本实验存在明显缺陷,请给出优化建议_____(写出一点即可)。
(4)工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与40kg氧化铁反应,理论上可制得铁的质量是多少_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁在国产大飞机“C919”的制造中大显身手。实验室模拟“海水制镁”的原理来富集镁,将20g氯化钠和氯化镁的固体混合物全部溶解于盛有100g水的烧杯中,然后向其中加入80g氢氧化钠溶液,恰好完全反应,过滤,称量滤液质量为194.2g,请计算:
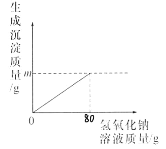
(1)图象中m=_____g;(结果精确到0.1g)。
(2)滤液中溶质的质量分数是多少____?(结果精确到0.1%)?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?____________________(写出计算过程)
(2)小婷同学另取10g黄铜于烧杯中,向烧杯中加入稀硫酸,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
加入稀硫酸的质量/g | 30 | 60 | 90 | 120 |
烧杯中剩余物的质量/g | 39.94 | m | 99.82 | 129.8 |
①表中m=____________,从表中的数据分析,当小婷同学加入_________g稀硫酸时,烧杯中刚好没有气泡产生。
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图像____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com