
【题目】下表是元素周期表的一部分,试回答下列问题:
第一周期 | 1H | 2He | ||||||
第二周期 | 3Li | 4Be | 5B | 6C | ① | ② | 9F | 10Ne |
第三周期 | 11Na | 12Mg | ③ | 14Si | 15P | 16S | 17Cl | 18Ar |
(1)①所示元素是__________(填“金属元素”或“非金属元素”);
(2)②所示元素与③所示元素形成的化合物的化学式是_____;
(3)下图是某元素的原子结构示意图,该原子在化学反应中易__________电子;离子符号为____________ 。

(4)下图是某元素的原子结构示意图,该元素的原子核外电子数为____。

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】在微观、宏观及符合之间建立联系是化学学科的特点之一。请分析并回答下列问题:
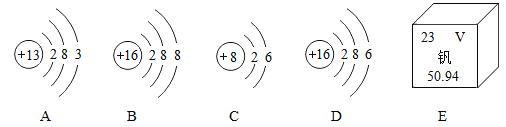
(1)图E所示元素的原子核内质子数为__________________。
(2)在A~D中,共有___________种不同元素
(3)A、C所表示的元素形成的化合物的化学式为_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式为:Na2SO4+BaCl2=2NaCl+BaSO4↓)
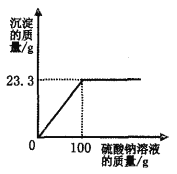
请计算:
(1)固体混合物中氯化钡的质量______________
(2)恰好完全反应时,所得溶液中溶质的质量分数______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
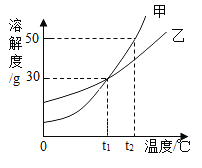
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.t1°C时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将t2°C150g甲的饱和溶液降温到t1°C,有20g固体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“克罗米”技术是指在眼镜的金属镜架、自行车车把与钢圈等金属表面镀上一层金属铬(Cr)。小明发现在常见金属活动性顺序中没有铬,于是他和小组同学一起探究铬与常见金属镁和铜的活动性强弱。
(查阅资料)铬(Cr) 是一种银白色金属,在空气中能形成一层致密的氧化膜,可阻止铬进一步被氧化;硫酸亚铬(CrSO4) 溶液呈蓝色,硫酸亚铬中铬元素的化合价为__。
(提出猜想)三种金属的活动性强弱为:
①Cr> Mg>Cu ②Mg>Cu>Cr ③____
[实验探究]
实验1 | 实验2 | 实验3 | 实验4 | |
实验方案 |
|
|
|
|
现象 | 无明显现象 | 铬片上有气泡产生,溶液逐渐变成蓝色 | 无明显现象 | ___ |
结论 | 猜想___正确 | |||
(交流与讨论)
(1)实验前所用的金属片都需用砂纸打磨,其目的是__。
(2)实验4中反应的化学方程式为___。
(3)结合探究结论,有同学提出四个实验可进行优化,只需选择三种药品,即可金属的活动性强弱。合理的选择是_____。
①硫酸镁溶液②硫酸亚铬溶液③硫酸铜溶液④稀硫酸⑤镁片⑥铬片⑦铜片
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A~E均是初中常见的物质,它们相互转化的关系如图所示。
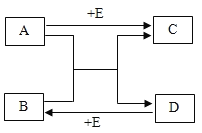
(1)若A与B均为黑色固体,且B中金属元素所占质量分数为80%,C是加剧温室效应的主要气体,E是气态单质。则A与B反应的化学方程式为______。E的一种用途是_____。
(2)若A与B发生的是复分解反应,E是CO2,则B的化学式为_____。A与E反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CO2 通入 NaOH 溶液中无明显现象,为探究 CO2 与 NaOH 溶液是否发生了反应,某兴 趣小组进行了如下探究:
(查阅文献)(1)20℃时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
(2)本实验条件下,Na2CO3 溶液和 NaHCO3 溶液的 pH 分别约为 11.0 和 8.5。
(3)Na2CO3可以和二氧化碳、水反应生成碳酸氢钠。
(实验探究)
(1)实验一:小明用注射器抽取 20mLCO2,再抽取 5mLNaOH 溶液, 立即将针头插进橡皮塞中,振荡,发现注射器活塞左移,最后停在 10mL 刻度处,证明二氧化碳与氢氧化钠溶液发生了反应。小丽认为小明的结论不合理,又增加了一个实 验:_____(写出操作、现象),得出小明的结论正确。
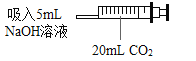
(2)实验二:小明又取实验一所得溶液少许于试管中,向其中滴加BaCl2溶液,观察到______(填 现象),证明 CO2 与 NaOH 溶液发生了反应。实验中不宜将 BaCl2 溶液换成 CaCl2 溶液的原因是____________________。
(3)实验三:小明继续向实验二的溶液中滴加 BaCl2溶液至过量,静置,取上层清液,滴入 2 滴 酚酞试液,发现溶液呈___ 色,证明溶液中有 NaOH 剩余。实验中,小明没有直接取实验一的溶液 滴入酚酞试液,理由是__________________________________。
(反思感悟)对于现象不明显的化学反应,可以通过______________________来证明反应的发生。
(4)实验四:兴趣小组同学用如图 1 装置将 CO2 持续通入一定浓度一定量的 NaOH 溶液中,用数 字化实验技术测定反应过程中溶液的 pH 变化,结果如图 2 所示。
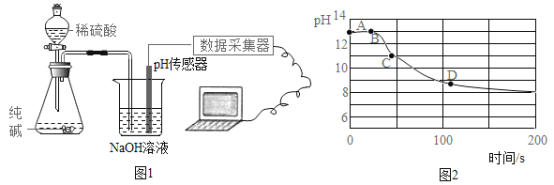
图 1 中,用纯碱与稀硫酸反应来制取二氧化碳,而不用大理石与盐酸反应来制取,理由是______________________________。最终溶液 pH 小于 8.5 的可能原因是__________________。CD 段发生反应的化学方程式为______________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读短文,回答问题。
灯的变迁
灯泡的发明给人类带来了光明,随着社会发展,我们使用的灯也在发生着变化。

1.白炽灯,白炽灯里的钨丝也害怕空气。如果玻壳里充满空气,那么通电以后,钨丝温度升高到2000°C以上,空气就会对它毫不留情地发动袭击,使它很快被烧断,同时生成一种黄白色的三氧化钨(化学式WO3),所以钨丝灯泡要抽成真空,把空气统统清除出去。有时怕抽气机抽不干净,还要在灯泡的感柱上涂一点红磷。白炽灯用久了玻壳会变黑,原因是长时间的高温使钨丝表面的钨不断地升华扩散,然后一层又一层地沉积到玻壳的内表面上,使玻壳慢慢变黑。
2.节能灯,节能灯通电时首先经过电子镇流器给灯管灯丝加热,灯丝开端发射电子(由于在灯丝上涂了一些电子粉),电子碰撞充装在灯管内的氩原子,氩原子碰撞后取得了能量又撞击内部的汞原子,汞原子在吸收能量后产生电离,灯管内构成等离子态发光。节能灯寿命长达8000小时,光效相当普通灯泡的6倍。较白炽灯节能70 ~ 80% ,低压快启,无频闪。但节能灯也有弊端,启动慢,灯管中汞也就不可避免地成为一大污染源,1只普通节能灯的含汞量约5毫克,仅够沾满一个圆珠笔尖,但渗入地下后可能造成1800吨水受污染。
3. LED灯,LED是发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电转化为光。白光LED的能耗仅为白炽灯的1/10,节能灯的1/4。寿命可达10万小时以上,是节能灯的10~20倍。绿色环保,不含铅、汞等污染元素,对环境没有任何污染。LED的内在特征决定了它是最理想的光源去代替传统的光源,它有着广泛的用途。
回答下列问题
(1)白炽灯变黑发生的变化是_____( 填“物理变化”或“化学变化”)。感柱上涂红磷发生反应的化学方程式是_____。
(2)LED灯与其他灯相比优点是_____。(说两点)
(3)下列说法错误的是_____。
A 节能灯内填充的只是氩气
B 这几种灯泡都能将电能转换成光能
C 白炽灯钨丝熔点大于2000℃
D LED灯在现阶段是最理想的光源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com