
为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 | l | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)Zn+H2SO4═ZnSO4+H2↑ (2)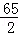 =
= 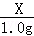 (3)49%
(3)49%
(4)32.2% (5)200 t.
解析试题分析:(1)锌和稀硫酸反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
(2)完全反应生成氢气的质量是1.0g,锌的质量为X,
Zn+H2SO4═ZnSO4+H2↑,
65 2
X 1.0g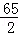 =
=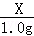 .
.
X=32.5g,
(3)根据第1次实验数据计算,稀硫酸和足量锌反应能生成0.4g氢气,
设40.0g稀硫酸中硫酸的质量为Y,参加反应的锌的质量为Z,生成硫酸锌的质量为m,
Zn+H2SO4═ZnSO4+H2↑,
65 98 161 2
Z Y m 0.4g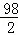 =
=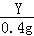 ,
,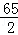 =
=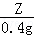 ,
,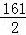 =
=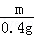 ,
,
Y=19.6g,Z=13g,m=32.2g,
参加反应的稀硫酸的溶质质量分数为: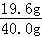 ×100%=49%;
×100%=49%;
(4)向第一次实验所得溶液中加入47.4g水后,溶液的质量为:40.0g+13g+47.4g﹣0.4g=100g,
溶液中溶质的质量分数为: ×100%=32.2%.
×100%=32.2%.
(5)125t含Cu2S 70%的辉铜矿中铜的质量为:125t×70%×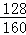 ×100%=70t,
×100%=70t,
由(2)中可知,50g黄铜中铜的质量为:50g﹣32.5g=17.5g,
黄铜中铜的质量分数为: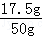 ×100%=35%,
×100%=35%,
理论上能炼制出黄铜的质量为:70t÷35%=200t.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:初中化学 来源: 题型:计算题
实验室需用氯酸钾制取氧气,化学方程式: 2 KClO3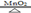 KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
(1)生成氧气的质量是多少?
(2)剩余固体中氯化钾质量是多少?
(3)固体剩余物中是否还含有氯酸钾?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%.
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
| 所称量的物质 | 实验1 | 实验2 | 实验3 | 实验4 |
| 加入纯碱产品质量/g | 2.8 | 5.6 | 11.2 | 14 |
| 烧杯中剩余物质量/g | 101.7 | 103.4 | 106.8 | 109.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学为测定某大理石中碳酸钙(假设:大理石中的杂质不与盐酸反应)的质量分数,取四份样品分别加稀盐酸反应,其实验数据记录如下:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 10.0 | 10.0 | 10.0 | 10.0 |
| 取稀盐酸质量(g) | 25.0 | 50.0 | 75.0 | 100.0 |
| 产生气体质量(g) | 1.1 | X | 3.3 | 3.3 |
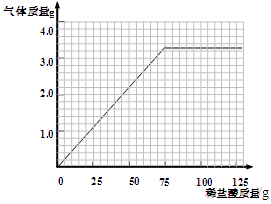
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。现取8g石灰石样品与足量的50g稀盐酸完全反应后,称得容器内的物质总质量为55.36g。
试回答下列问题:
(1)反应后容器内的物质有 。
(2)反应产生二氧化碳的质量为 。
(3)该石灰石样品中碳酸钙的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是NaOH和Na2CO3的混合物;猜想二、可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层溶液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据实验现象,可判断 是正确的。
(2)称取10.6克该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某兴趣小组的同学对食品中含有的维生素C(化学式为C6H8O6,可表示为Vc)进行探究.
(1)向含有Vc的溶液中滴加紫色石蕊,溶液变红,说明Vc具有的性质是 .
(2)食品中的Vc被氧气氧化时,其含量的变化如图所示,由此可得出的结论有 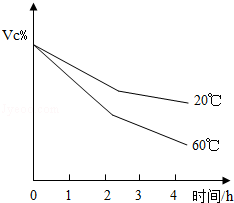
(3)小杰对某果汁饮料中Vc的含量进行测定.反应原理为C6H8O6+I2=C6H6O6+2HI,其中碘元素在反应中的 化合价变化是 .实验时取果汁饮料10mL,用煮 沸并冷却的蒸馏水稀释至50mL,向其中逐滴加入稀碘水至恰好完全反应,测得消耗碘(I2)的质量为25.4mg.则每100mL该果汁饮料中含Vc的质量是 .
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
钢铁在生产、生活中有着广泛的应用。
(1)钢铁属于_________(填“纯净物”或“混合物”);钢铁在空气中锈蚀是铁跟空气中的水蒸气和_________共同作用的结果。为了防止钢铁的锈蚀,人们除采用在其表面涂油漆的方法外,还可_________(任填一种方法);工业上用稀盐酸除去铁锈(主要成分为Fe2O3),写出该反应的化学方程式:_________________________。
(2)某钢铁厂为分析赤铁矿中Fe2O3的质量分数:准确称取20g样品,在高温条件下用足量CO气体还原,充分反应(假设其他杂质不与CO反应)后冷却、称重,质量为15.2g。计算该赤铁矿样品中Fe2O3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com